El Agua
Por
Ing. Agr. Carlos A. González
La molécula inorgánica del agua es una de las más
importantes en la naturaleza. En un organismo vivo, representa desde un

Cabe mencionar que el agua es un factor ambiental de gran importancia, pues muchos organismos desarrollan su existencia en lugares como los mares, ríos, lagos charcas, etc.
|
¿Sabía
que...? SON NECESARIOS |
Gracias a la característica polar de su molécula, el agua favorece la disociación de muchas otras moléculas, tanto orgánicas como inorgánicas. Esta propiedad de actuar como "solvente universal" y la tendencia de los átomos de ciertos compuestos a formar iones cuando están en solución, favorece un cometido importante: facilitar las reacciones químicas.
Propiedades generales:
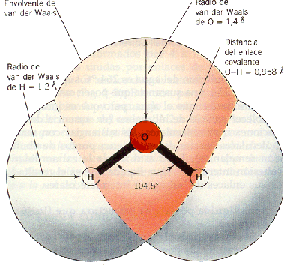
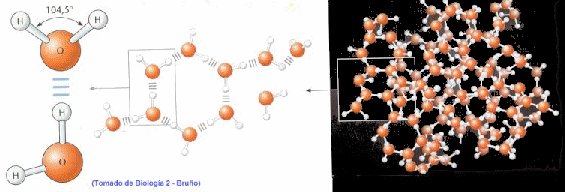
Las propiedades del agua se deben especialmente a la relación física que hay entre los átomos de H y el de O.
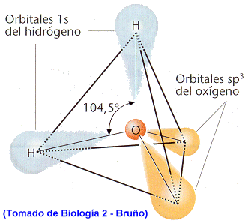
a. Los dos átomos de H se unen covalentemente al O y, debido a características químicas, lo hacen por una cara del átomo de oxígeno, dándole asimetría a la molécula.
b. El átomo de O tiene un núcleo mayor, o sea una carga positiva más fuerte, provocando una mayor fuerza de atracción de electrones del H.
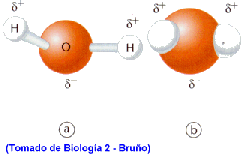
La combinación de estas dos propiedades trae como consecuencia que la molécula de agua tenga un extremo más electronegativo (la zona del O) y otro extremo menos electronegativo (la zona de los H), dándole a la totalidad de la molécula cierta polaridad (Fig 1, 2 y 3).
|
Fig. 1 |
|
Fig. 2 |
|
|
||
|
Fig. 4 |
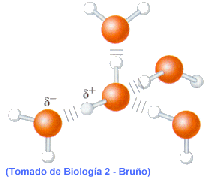
Por ello las moléculas de agua tienden a unirse por la atracción electrostática entre los átomos de H cargado positivamente y otro átomo, el O, cargado negativamente, formando uniones o enlaces "Puente Hidrógeno" (fig. 4).
|
Propiedades particulares:
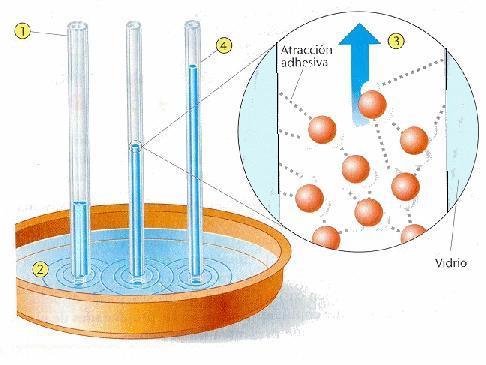
1) Fuerzas de cohesión y
adhesión
Las moléculas de agua tienden, como dijimos anteriormente, a unirse entre sí mediante los enlaces puente hidrógeno. A esta característica se la llama cohesión (fig. 5). El agua presenta otra particularidad, y es que moja la mayoría de los objetos. Esto se debe a la adhesión. La adhesión se debe a que las superficies que se ponen en contacto con el agua presentan átomos o moléculas cargadas.
|
Fig. 5 |
La cohesión existente entre las moléculas de agua hace que este compuesto tenga un alto grado de tensión superficial. Esta tensión, que se produce sobre las moléculas de la superficie libre, hace que éstas se agrupen. De esta manera se produce una fuerte capa debido a la atracción que ejercen sobre ellas otras moléculas de agua situadas por debajo.
Las fuerzas de cohesión y de adhesión producen otro fenómeno en el agua, que recibe el nombre de capilaridad (fig. 6). La capilaridad es la tendencia del agua a ascender por los tubos de calibre muy pequeño.
|
Capilaridad (Fig. 6) |
2) Buffer de temperatura
Cuando le preguntamos a los alumnos de una clase ¿qué se calienta más rápido, el aire, el metal o el agua?, las respuestas suelen ser muy diversas.
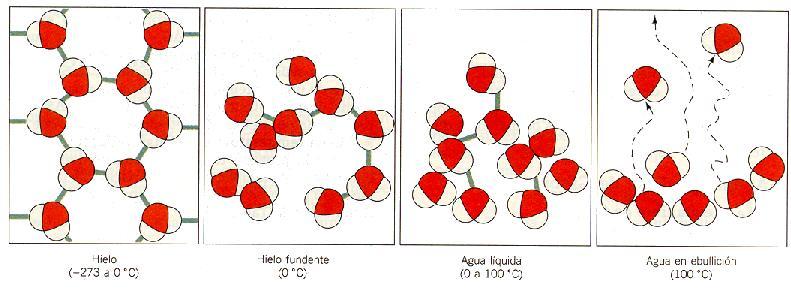
Debemos tener en cuenta que la temperatura de un cuerpo está relacionada directamente con la vibración de sus átomos o moléculas. Cuanto mayor sea la vibración, mayor será la temperatura del cuerpo (fig. 7).
|
(Fig. 7) La estructura
del agua, o cualquier otra sustancia, va desordenándose de un modo creciente,
es decir, aumenta su entropía, a medida que aumenta su temperatura. |
El agua tiene uno de los calores específicos más elevados entre las sustancias naturales. Esto significa que es mucha la energía necesaria para elevar la temperatura del agua en un grado centígrado.
¿Por qué se debe aplicar mucha energía?
Si recordamos que el agua esta conformada por varias moléculas, y que éstas están unidas por puentes hidrógenos, nos queda pensar que la energía calórica que se está aplicando va a ser utilizada primero para romper dichos enlaces, y que el resto de la energía disponible será utilizada para acelerar las moléculas que se van liberando, incrementando así la temperatura del agua.
Esto nos indica que el agua puede absorber grandes cantidades de calor, sufriendo cambios relativamente pequeños en su temperatura. Por otra parte, cuando el agua se solidifica (se transforma en hielo), emite cantidades relativamente grandes de calor al ambiente. A esta característica se la llama calor latente de fusión. Por último, para el pasaje de un estado líquido a uno gaseoso, se necesitan 540 calorías para convertir un gramo de agua en un gramo de vapor. Esto se conoce como calor latente de vaporización. En animales o plantas este mecanismo es muy importante. En el hombre, por ejemplo, sirve para que la superficie del cuerpo se deshaga de grandes cantidades de calor durante un ejercicio físico (cuando el sudor se evapora); o en las plantas, que para mantenerse frescas frente a una luz muy intensa evaporan agua a través de la superficie.
Realice la actividad 10
Resumiendo: en los organismos vivos, el agua actúa como un amortiguador de los cambios bruscos de la temperatura.
|
¿Sabía
que...? Cuando se evapora el agua o cualquier otro líquido, disminuye la temperatura, lo que constituye un método eficaz en los vertebrados para disipar calor por sudoración; también las plantas utilizan este sistema de refrigeración, sobre todo algunas como el tomillo, el romero, etc. Estas plantas están adaptadas a los ambientes calurosos del verano, mediante el almacenamiento de esencias volátiles, cuya evaporación provoca un ligero descenso de la temperatura en su entorno. |
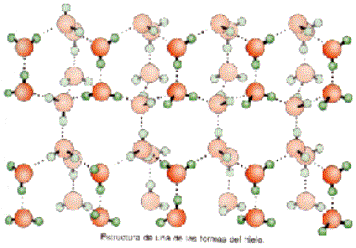
3) Densidad del agua
Mientras que la mayoría de las sustancias tienden
a aumentar su densidad conforme disminuye la temperatura, el agua alcanza su
mayor densidad a los
|
Fig. 8 |
Fig. 9 |
Gracias a esta anomalía del agua, los lagos, ríos
y mares comienzan a congelarse desde la superficie hacia abajo, y esta costra
de hielo superficial sirve de abrigo a muchos seres vivos, pues aunque la
temperatura ambiental sea extremadamente baja (-50 o -60º C), el agua de la
superficie transformada en hielo mantiene constante su temperatura en
4) Ionización del agua
El agua tiene una tendencia a la ionización, o sea a disociarse en forma de iones (H+, hidrógeno y OH-, hidróxido). El agua tiende a mantener un equilibrio constante entre la forma molecular y la forma iónica.
H2O ß
----------------------à H+
+ OH-
Como la cantidad de iones H y la cantidad de iones OH son exactamente iguales, se dice que esa solución es neutra (en la naturaleza, el agua no es un líquido químicamente puro, ya que se trata de una solución iónica que siempre contiene algunos iones H3O+ y OH- ). Para simplificar la explicación se utiliza el símbolo H+, en lugar de H3O+). En el agua pura la disociación es tan escasa que, en un punto de equilibrio, 1 mol (18 gr.) de agua produce 10-7 moles de H+ y 10-7 moles de OH- por litro.
|
Masa
molecular La masa molecular de un compuesto es la suma
de los pesos atómicos que lo forman. Por ejemplo la masa molecular del H2O
es igual 1 + 1 +16 = 18 unidades de masa (se debe tener en cuenta que en
realidad el valor sería algo superior , pero para los fines que nuestra
materia es suficiente). Otro ejemplo puede ser el de la glucosa, cuya fórmula
es C6H12O6 , cuya unidad de masa es ( 6 x
12) + ( 12 x 1) + (6 x 16) = 180. La cantidad de un compuesto cuya masa en
gramos equivale a su masa molecular se denomina mol. Así, un mol de glucosa tiene una masa de |
Por último, el agua es transparente; gracias a
ello no interfiere procesos como la fotosíntesis y la visión, dos fenómenos
para lo que es necesario el paso libre de la luz.
5) Elevada constante
dieléctrica
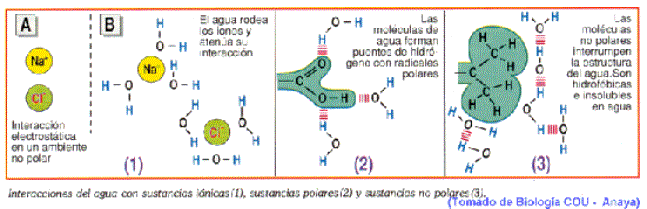
Por tener moléculas dipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos.
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica. Por ejemplo:
|
H2O CH3COOH ------------------------------ à CH3COO- + H+ |
|||
|
|
ac. Acético |
ion acetato + |
ion hidrógeno |
|
H2O NH4OH-----------------------------------à NH4+
+ OH- hidróxido amónio ---------------------------------ion amoniaco + ion hidróxilo |
|||
Son muchos los iones que aparecen disueltos en las células animales y vegetales y que tienen un papel preponderante en el metabolismo. Por ejemplo: algunos cationes, como el Na+ y el K+, desempeñan una función vital en la transmisión de los impulsos nerviosos; el Ca+ interviene en la contracción muscular y en el movimiento de los microtúbulos de cilias y flagelos. También podemos mencionar algunos aniones como el fosfato (PO3-4), importante en la regulación energética, o los cloruros (Cl-) importantes en la producción de orina, etc.
|
Fig. 10 |