Composición Química de
Autor:
Por el Ing. Agr. Carlos A. González
Corrector: Patricia Nirimberk de Chiesa
Si nos remontamos a los comienzos de la ciencia, nos encontramos con
que ésta se basa en la filosofía mecanisista, según la cual son los principios de las leyes químicas y
físicas los que estipulan las leyes de
A partir de este planteo, muchos investigadores trataron de responder a
preguntas como: ¿puede cualquier cuerpo con vida estar compuesto por los mismos
elementos químicos que componen la materia no viva?, ¿pueden ser explicadas las
funciones vitales de los sistemas vivientes en términos de las reacciones
químicas que también tienen lugar en los cuerpos inanimados?
Las respuestas comenzaron a surgir gracias a los experimentos
realizados por numerosos biólogos especializados en biología celular y
molecular. Las pruebas que se van acumulando en el tiempo apoyan de manera
acabada la teoría mecanisista.
Algunas de las conclusiones
a las que se ha llegado fueron que los elementos químicos y las reacciones
químicas de los sistemas vivientes no difieren fundamentalmente de los que se
encuentran en cualquier otro tipo de objetos. Además "los individuos no tienen vida en
virtud de la materia que los compone, sino en la manera en que su materia esté
especialmente organizada"
Perspectivas Inorgánicas:
En el universo
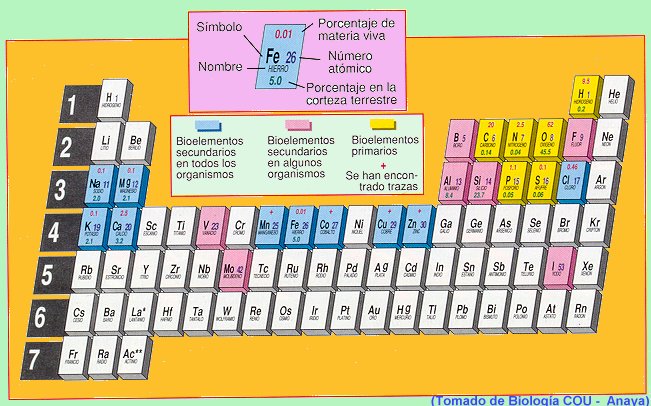
existen ciertas clases de materiales, conocidos con el término de "bioelementos",
que son elementos químicos (Cuadro
1) que se encuentran en la materia viva.
|
Elemento Símbolo Valencias comunes |
|
Atendiendo a su abundancia se pueden clasificar en: a) Bioelementos
primarios, que aparecen en una proporción media del 96% en la materia viva, y
son: H-O-C-N-S y P. (Cuadro 2.1.) b) Bioelementos
secundarios, que aparecen en una proporción cercana al 3,3%. Son: Ca, Na, K, Mg
y Cl, y desempeñan funciones de vital importancia en fisiología celular. c) Oligoelementos o micro constituyentes,
que aparecen en la materia viva en proporción inferior al 0,1% y que también
son esenciales para la vida: hierro, manganeso, cobre, zinc, flúor, yodo, boro,
silicio, vanadio, cobalto, selenio, molibdeno y estaño. Aunque participen en
cantidades infinitesimales, no por ello son menos importantes, pues su
carencia puede acarrear graves trastornos a los organismos. (Cuadro 2.2.) Los elementos son unidades formadas por un mismo tipo de "átomo", o, lo que es lo
mismo, el átomo es la unidad fundamental de un elemento |
||
|
Hidrógeno Sodio Potasio Carbono Cloro Calcio Magnesio Azufre Oxígeno Hierro Fósforo Nitrógeno |
H Na K C Cl Ca Mg S O Fe P N |
1 1 1 4 1 2 2 2-4 2 2-3 3 3 |
||
|
(Cuadro 1) Elementos químicos |
||||
Cuadro 2.1. Elementos mayores presentes en el cuerpo humano
|
Nombre |
masa % |
Importancia
o función |
|
Oxígeno |
65 |
Necesario para la respiración celular; presente
en casi todos los compuestos orgánicos; forma parte del agua |
|
Carbono |
18 |
Constituye el esqueleto de las moléculas orgánicas;
puede formar cuatro enlaces con otros tantos átomos |
|
Hidrógeno |
10 |
Presente en la mayoría de los compuestos
orgánicos; forma parte del agua |
|
Nitrógeno |
3 |
Componente de todas las proteínas y ácidos
nucleicos y de algunos lípidos |
|
Calcio |
1,5 |
Componente estructural de los huesos y dientes;
importante en la contracción muscular, conducción de impulsos nerviosos y
coagulación de la sangre |
|
Fósforo |
1 |
Componente de los ácidos nucleicos; componente
estructural del hueso; importante en la transferencia de energía. Integra los
fosfolípidos de la membrana celular. |
Cuadro 2.2. Principales Oligoelementos presentes en el cuerpo humano
|
Potasio |
0.4 |
Principal ion positivo (catión) del interior de
las células; importante en el funcionamiento nervioso; afecta a la
contracción muscular |
|
Azufre |
0,3 |
Componente de la mayoría de las proteínas |
|
Sodio |
0,2 |
Principal ion positivo del líquido intersticial
(tisular); importante en el equilibrio hídrico del cuerpo; esencial para la
conducción de impulsos nerviosos |
|
Magnesio |
0,1 |
Necesario para la sangre y los tejidos del
cuerpo; forma parte de casi todas las enzimas de importancia |
|
Cloro |
0,1 |
Principal ion negativo (anión) del líquido
intersticial; importante en el equilibrio hídrico |
|
Hierro |
trazas |
Componente de la hemoglobina y mioglobina; forma
parte de ciertas enzimas |
|
Yodo |
trazas |
Componente de las hormonas tiroideas |
Cualidades generales de los
átomos:
- A los elementos se los simboliza con la primera y segunda letra
de su nombre en español o latín (cuadro 1).
- Cuando hay más de un átomo idéntico se coloca por delante de la letra
el número de unidades.
- Los átomos se pueden combinar con otros átomos a través de "fuerzas
de interacción específica"
¿Cuáles son las cualidades particulares del átomo?
La palabra átomo significa “algo que no puede ser fraccionado”
El átomo es una partícula tan diminuta que es imposible de ver bajo el
microscopio óptico. Sólo con el avance de la tecnología, los investigadores
pudieron visualizar los átomos a través de los microscopios de barrido
electrónico. Con ellos se logra aumentar el tamaño de un objeto hasta 5.
000.000 de veces, con lo cual se pudieron obtener fotografías de los átomos de
mayor tamaño, como por ejemplo, el del uranio.
El átomo está constituido por un núcleo atómico con cargas positivas
(+), llamadas protones, y neutras, llamadas neutrones (en las últimas
décadas los físicos descubrieron unidades más pequeñas dentro del núcleo,
llamadas quarks). También orbitando
alrededor de ese núcleo, se presentan una o más partículas llamadas electrones,
que tienen carga negativa y son 1/1800 veces más pequeños que el protón.
El átomo más
sencillo es el del hidrógeno, que posee un solo electrón en su órbita. Pero
existen otros mucho más complejos que pueden tener hasta 106 electrones, en
diversas capas electrónicas concéntricas que envuelven al núcleo. Cada
capa a su vez puede tener uno o más orbitales, en donde se encuentran
los electrones.
|
Los electrones que ocupan orbitales cercanos al
núcleo tienen menos energía asociada
con su rápido giro orbital. En cambio, los electrones de los orbitales
más lejanos tienen más energía porque
su giro es más lento. Cuando un átomo absorbe energía, uno de los electrones cercanos a su núcleo se desplaza a un nivel de mayor energía y más lejos del núcleo. Estos cambios o intercambios de energía dentro del átomo se denominan paquetes de energía o "cuantos" energéticos, que equivalen al promedio de la diferencia entre dos orbitales diferentes. |
|
|
Ahora bien, cuando el electrón excitado deja esa órbita superior y
vuelve a la anterior, esa diferencia de energía es entregada al medio como cuanto en forma de luz ("fluorescencia")
Otra característica que tienen los electrones se vincula con su dirección, que se denomina espín
del electrón.
Cuando un átomo
presenta la misma cantidad de
protones y electrones, a ese número balanceado se lo denomina "número
atómico" del elemento. En cambio, el número de protones más
neutrones determina el "peso atómico" o "número
de masa".
|
Realice la actividad 1 |
|
¿Sabía
que...? Puede existir la posibilidad de que los átomos de un elemento presenten
el mismo número atómico pero diferencias en su peso atómico. Esto se debe a
una variación en el número de neutrones presentes en el núcleo. A estos
elementos se lo llama isótopos, que siguen
manteniendo la característica del elemento al que representan porque la
conformación electrónica orbital se mantiene intacta. Por ejemplo, existen tres isótopos naturales del
hidrógeno, el protio
(1H), el deuterio
(2H) y el tritio
(3H). Todos poseen las mismas propiedades químicas del hidrógeno, y pueden
ser diferenciados únicamente por ciertas propiedades físicas. Los isótopos producen la emisión de partículas y rayos radiactivos. Esta particularidad es utilizada para la investigación, ya que permite marcar átomos individuales. |
Organicemos a los átomos:
Como mencionamos anteriormente, los átomos presentan capas electrónicas
y orbitales. En total, las capas son siete, y se las reconoce con distintas
letras: K-L-M-N-O-P-Q. La primera
capa, "K", contiene un solo orbital esférico que da cabida
a dos electrones. La segunda capa, "L", más alejada del núcleo,
contiene cuatro orbitales, y en ella
cada orbital tiene dos electrones. Por lo tanto, esta capa puede albergar hasta
ocho electrones. La capa "M"
puede contener de cuatro a nueve orbitales. Desde la capa L hasta
|
Por lo general
(no siempre), las capas más próximas al núcleo quedan completas antes de que
empiece a haber electrones en las capas externas, ya que la estabilidad
atómica depende de que cada disposición de los electrones en el espacio se
mantenga en el menor nivel de energía.
|
|
Fig.1. |
|
El número máximo de electrones que puede
haber en cada nivel cuántico n corresponde a la formula: nº = 2.n2siendo
n el nivel cuántico. Ejemplo: K 1....... 2 x 11 = 2 L 2....... 2 x 22 = 8 M 3...... 2 x 32 = 18 N 4....... 2 x 42 = 32 O 5 ................ = 18 P 6 ................ = 8 Q 7 ................ = 2 |
Los subniveles o también llamados
orbitales, fueron designados por la espectroscopia, con las letras: Orbital Significado s nítido p principal d difuso f fundamental
|
|
Ej: El Oxígeno,
tiene Nº atómico 8 Núcleo 8 protones Peso atómico 16 8
neutrones Su distribución
será: 2e, en el orbital esférico de la capa K 6e, repartidos en 2e c/orbital
de la capa L, quedando 1 orbital sin electrones. |
|
Realice la actividad 2 |
Las propiedades
químicas que presentan los átomos debido, en gran medida, al número de
electrones presentes en sus capas electrónicas externas, hizo que el hombre
tratara de organizarlos. En 1869, Dimitri Mendeleev, representa un ordenamiento
de los elementos conforme a sus pesos cada vez mayores, planteando para el
siglo XIX la existencia de 89 elementos que conforman la "Tabla
Periódica de los Elementos". En el presente se cuenta con 106
elementos (fig. 2). Se descubrió que las propiedades químicas de los elementos
anotados en la lista exhibían una periodicidad o regularidad repetitiva.
|
Fig.2 |
Veamos
de qué se trata:
Si los elementos se disponen conforme a su número atómico creciente,
surge un patrón en el cual las hileras de átomos progresan desde un electrón en
la capa más externa, hasta el máximo posible de electrones en dicha capa. Por
ejemplo: el hidrógeno es el primer elemento y su capa K tiene un electrón; el
segundo elemento es el helio, que completa su capa K con dos electrones. Cada
hilera horizontal de números atómicos crecientes se denomina período.
Las columnas, cuyos elementos son similares por el número de electrones que
contienen las capas externas, constituyen un grupo.
Por ejemplo:
- Los Gases Nobles o
elementos inertes, como el Neón y el Helio, son los últimos elementos de una
serie de períodos y constituyen la última columna. Son los únicos que tienen la
capa más externa completa.
- A todos los elementos del "Grupo I", como por
ejemplo el Li y el Na, les es más fácil perder el único electrón de su capa más
externa.
- Análogamente, a todos los elementos del "Grupo II y del "Grupo
III", les resulta más fácil también perder dos o tres electrones
de su capa más externa. Ejemplo: Mg; Al.
- A todos los elementos de los "Grupos V, VI y VII", les
es más fácil adquirir tres, dos o un electrón para completar su órbita más
externa.
El átomo que cedió electrones, presenta por ello características
"electropositivas", dado que las cargas entre
protones y electrones se desbalancea, dominando por ello las cargas del núcleo.
Por este motivo el elemento pasa a ser un "ión
electropositivo” o
“catión". A estos se los llama elementos con "carácter
metálico".
El átomo que adquiere electrones presenta características
"electronegativas", pues hay más electrones que protones. Por eso se
los denomina "iones electronegativos” o “aniones". Estos
son elementos con "carácter no metálico".
- Los elementos del "Grupo IV", como el
carbono o el sílice, poseen en su órbita más externa cuatro electrones, por lo
cual da lo mismo que pierdan o ganen
esos cuatro electrones para completar su órbita. Su carácter es intermedio,
entre metálico y no metálico, y reciben el nombre de "anfóteros".
Cuando hicimos referencia a las cualidades generales de los átomos,
dijimos que tenían la capacidad de combinarse entre sí mediante fuerzas de
interacción específica. Cuando ello sucede, se forma un "compuesto químico",
cuya característica es que los elementos
son diferentes y están combinados en proporciones fijas.
Las características de un compuesto químico son muy diferentes a las de
los elementos que lo componen. Por ejemplo: a temperatura ambiente, el agua es
un líquido, mientras que el oxígeno o el hidrógeno son gaseosos.
Cada compuesto químico tiene un nombre y una fórmula química o
estructural. Para expresarla se utilizan como símbolos las letras de los átomos
que lo conforman y unos números como subíndice que señalan el número de átomos
presentes en ella (cuadro 2).
|
La fórmula estructural no sólo brinda información sobre la cantidad de elementos que se encuentran en el compuesto, sino que también nos dice la disposición de dichos elementos en el espacio. Por ejemplo: el agua se describe de la siguiente forma: H-O-H. |
|
H2O (óxido de hidrógeno) ClNa (cloruro de sodio) Fe2O3 (óxido
de hierro) Ca3(PO4)2 (fosfato
de calcio) Formula química (Cuadro 2) |
La unión hace la fuerza:
1.
Uniones interatómicas
2.
Uniones intermoleculares
1.
Uniones interatómicas
En la naturaleza se pueden encontrar diversos enlaces de átomos, debido
a las características diferentes que presentan cada uno de ellos.
·
Cuando entre dos átomos se produce una translación de electrones de uno
a otro, y dichos "iones" son de cargas opuestas, se dará una atracción
electrostática entre sí. Este tipo de unión se conoce como "enlace
iónico" que, por ello, forma un "compuesto iónico".
|
|
·
Cuando entre dos átomos se produce una traslación de electrones en ambos
sentidos, y dichos electrones comparten la última capa de cada átomo, se
constituye un "enlace covalente", formándose por ello una "molécula".
|
|
Estos enlaces se puede compartir desde
1 par, 2 y hasta 3 pares de electrones.
|
|
·
A diferencia de lo planteado hasta este momento, los electrones del par
que se comparte pueden ser aportados por un mismo átomo. Esto es muy común
entre átomos de nitrógeno y fósforo con el hidrógeno o con el oxígeno
En muchos enlaces covalentes, el par de electrones
puede quedar más próximo a uno de los átomos. Esto le confiere a la molécula
cierto grado de polaridad (como la
que tiene, por ejemplo, el agua) lo cual la convierte en una unión "covalente polar". En otros casos,
la distribución es más equivalente y armoniosa, dando un carácter apolar (unión
"covalente apolar") como
sucede con casi todos los compuestos orgánicos.
2.
Uniones intermoleculares
Este tipo de unión ocurre entre moléculas, y se produce en función de
las caracteristísticas que aportan cada una de ellas, ya sea por el tipo de
unión covalente que contengan o por el tipo de carga neta de los átomos
ionizados.
Entre las más destacadas podemos mencionar:
·
Uniones Puente de Hidrógeno
Son uniones entre
átomos de hidrógeno que se ligan covalentemente a un átomo de O o N, o entre
algún otro elemento electronegativo de una molécula y otro átomo de gran
electronegatividad de una molécula cercana (fig. 3). Los enlaces por puentes de
hidrógeno son, aproximadamente, 1/20 más débiles que los enlaces covalentes. El
hecho de que alrededor de cada molécula de agua se dispongan otras moléculas
unidas por puentes de hidrógeno, permite que se forme en el seno del agua una
estructura ordenada de tipo reticular, responsable en gran parte de su
comportamiento anómalo y de sus propiedades físicas y químicas.
|
fig. 3 |
|
Son uniones que
se rompen y se forman fácilmente, pero son las más fuertes entre las uniones
moleculares. Por ser enlaces que forman largas cadenas y ser orientados, tiene gran importancia en la formación de estructuras tridimensionales y permitir cierta funcionalidad de macromoléculas biológicas como el ADN, proteínas. |
·
Uniones de van der Waals
Son fuerzas que se presentan cuando
las moléculas, por estar muy próximas entre sí, se ven sometidas a ciertas
interacciones, lo cual produce desplazamientos temporarios de sus nubes
electrónicas (fig. 4).
|
fig. 4 |
|
Estas fuerzas son muy débiles y menos específicas que cualquiera de las uniones anteriores. Su acción es directamente proporcional al número de moléculas. |