ORGANELOS TRANSDUCTORES DE ENERGÍA
CLOROPLASTOS Y FOTOSÍNTESIS
![]()
PLÁSTIDOS
Con este nombre se denomina genéricamente a un grupo de organelas que producen y almacenan productos nutritivos en algas y plantas. Todos los plástidos derivan de proplástidos, que son pequeñas organelas presentes en los tejidos meristemáticos (tejidos en activa división). Los etioplastos son plástidos de hojas crecidas en ausencia de luz, que cuando se exponen a la luz se desarrollan en cloroplastos (Fig. 1). Los amiloplastos son plástidos especiales que reservan almidón en los tejidos no fotosintéticos.
Los cloroplastos son el tipo más común de plástidos: estas organelas contienen clorofila, un pigmento de color verde del cual hay varios tipos, que difieren ligeramente entre sí (en las plantas terrestres las clorofilas más comunes son las clorofilas a y b, pero en las algas hay otros tipos como c y d) que atrapan la energía que provee la luz solar para realizar la fotosíntesis. Los cloroplastos también contienen una variedad de pigmentos amarillos y naranjas llamados carotenoides que absorben radiaciones luminosas en zonas del espectro visible donde no absorben las clorofilas y por ello se denominan pigmentos fotosintéticos accesorios o auxiliares.
Un alga unicelular puede contener sólo un
gran cloroplasto, en tanto que la célula de una hoja puede tener de
|
|
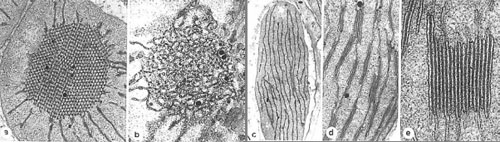
Etapas de transformación de un etioplasto (a) cuando
se expone a la luz. En el centro de la fotografía se observa una estructura
(cuerpo prolamelar) que será el origen de los tilacoides. Luego de tan sólo
un minuto de exposición a la luz el cuerpo prolamelar se organiza en
laminillas (b). Al cabo de otro minuto de exposición (c) comienzan a
distribuirse las laminillas. Luego de 24 horas de exposición a la luz (d) se
observan los primeros grana (asociación de membranas tilacoidales). En
(e) puede verse un granum totalmente desarrollado. |
|
Fig. 1 |
|
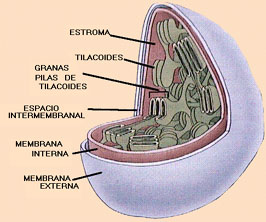
Los cloroplastos son organelos complejos, en forma típica de disco, delimitados por dos membranas, una interna y otra externa. El espacio delimitado por la membrana interna, llamado estroma, que es análogo a la matriz mitocondrial, contiene enzimas encargadas de producir glucosa a partir de dióxido de carbono y agua, utilizando energía obtenida de la luz solar, así como ribosomas, ARN y ADN. La membrana interna de los cloroplastos también engloba un tercer sistema de membranas, que consta de sacos planos, en forma discoidal, interconectados unos con otros, llamados tilacoides. En los cloroplastos estas membranas forman un tercer compartimiento, cuyo interior se denomina espacio intratilacoidal. Los espacios intratilacoidales parecen estar conectados entre sí y se agrupan formando pilas (granum, plural grana). Tales membranas, ricas en clorofila, se asemejan a la membrana interna de la mitocondria por el hecho de que ambas intervienen en la formación de ATP. La energía atrapada por las moléculas de clorofila a partir de la luz solar es utilizada para excitar electrones que se utilizarán en la formación de moléculas de ATP y de poder reductor (NADPH, equivalente al NADH). Esta energía química será luego utilizada en el estroma para obtener glucosa partir de dióxido de carbono y agua.
Transporte de proteínas hacia los cloroplastos
Aunque casi todo el ADN de las células eucarióticas se encuentra en el núcleo, los cloroplastos (al igual que las mitocondrias) contienen moléculas de ADN en sus compartimientos internos, así como ribosomas, lo que les permite producir un pequeño número de las proteínas que se encuentran en estas organelas. Sin embargo, la mayor parte de las proteínas que se encuentran en los cloroplastos son fabricadas en los ribosomas libres que se encuentran en el citoplasma, que después son transportadas al sitio adecuado de la organela.
Son relativamente pocas las proteínas codificadas por el genoma del cloroplasto y usualmente se ubican en la membrana tilacoidal de los cloroplastos; en muchos casos ser trata de subunidades de proteínas complejas que tienen que ensamblarse luego con otras subunidades codificadas en el genoma nuclear.
Al igual que lo que ocurre en las mitocondrias, las proteínas destinadas a los cloroplastos son orientadas hacia estas organelas por secuencias de señal específicas que tienen que ser reconocidas por una proteína de la membrana externa del cloroplasto. De acuerdo a su ubicación final, la proteína atraviesa una o las dos membranas y eventualmente llega al estroma o a los tilacoides de los grana. En el caso de las células vegetales, ambas organelas (mitocondrias y cloroplastos) están contenidos en la misma célula, por lo que las proteínas citoplasmáticas destinadas a cada una de ellas tendrán que contener diferentes secuencias de señal.
Los cloroplastos plantean un problema adicional, ya que contienen un tercer compartimiento, que es la membrana tilacoidal y el espacio intratilacoidal. En este caso hay una secuencia de señal que debe ser eliminada por una peptidasa de señal una vez que la proteína precursora haya entrado al estroma, desenmascarando así a la segunda peptidasa de señal que indica que el destino de la proteína es intratilacoidal; dentro del tilacoide una segunda peptidasa de señal liberará la cadena polipeptídica definitiva, que iniciará entonces su plegamiento.
Los genomas de los cloroplastos
Como ya se ha dicho, la mayoría de las proteínas presentes en los cloroplastos son codificadas por el ADN nuclear, pero parte de las mismas son sintetizadas en las propias organelas. El tráfico de proteínas está dirigido solamente desde el citoplasma hacia los cloroplastos; no se conoce que se importen proteínas desde el cloroplasto hacia el citoplasma.
Del mismo modo que lo que ocurre con las mitocondrias, los cloroplastos no se hacen de novo: siempre provienen de la división de cloroplastos ya existentes y esta división no necesariamente está en fase con la división celular. Antes de la división debe dividirse el ADN cloroplástico, de modo que las células hijas posean una cantidad de cloroplastos equivalentes a los que poseía la célula madre. La división ocurre por fisión binaria, como en las bacterias.
El ADN cloroplástico es bastante simple y,
salvo en algunas algas, es de tipo circular y no parece contener histonas
asociadas, tal como ocurre en las bacterias. De todos modos es sorprendente que
la maquinaria de síntesis proteica se parezca más a la de las bacterias que a
la de células eucariotas. Esto es particularmente cierto en cloroplastos, donde
los ribosomas son similares a los de Escherichia coli, tanto en su
estructura como en la sensibilidad a los antibióticos. Además la síntesis de
péptidos empieza con N-formilmetionina y no con metionina y el ADN
cloroplástico puede ser transcripto por
Como ya ha sido expresado antes, la
existencia de un juego separado de moléculas de ADN en cloroplastos, junto con
otras características semejantes a las de células procarióticas, han sido la
causa de que algunos biólogos supongan que estas organelas evolucionaron a
partir de organismos procarióticos que originalmente vivían en células de mayor
tamaño y que se han adaptado poco a poco, de manera que ya no son organismos
autónomos. Esta idea se ha incorporado como un elemento importante de la teoría
(denominada endosimbiótica) acerca de cómo surgieron los organismos
eucariontes [1]
.
Los cloroplastos constituyen el lugar en donde se lleva a cabo la fotosíntesis
 Las
plantas, las algas y algunas bacterias son productores únicos capaces de
transformar la energía solar en energía química, mediante el proceso de la
fotosíntesis. Cada año estos destacados organismos producen más de 200 mil
millones de toneladas de nutrientes. La energía química almacenada en éstos
sirve de combustible para las reacciones metabólicas que mantienen la vida en
la tierra.
Las
plantas, las algas y algunas bacterias son productores únicos capaces de
transformar la energía solar en energía química, mediante el proceso de la
fotosíntesis. Cada año estos destacados organismos producen más de 200 mil
millones de toneladas de nutrientes. La energía química almacenada en éstos
sirve de combustible para las reacciones metabólicas que mantienen la vida en
la tierra.
Los productores son organismos autótrofos (que se nutren a sí mismos: del griego autos que significa "a uno mismo" y trophos que significa "nutrición"), es decir que se trata de organismos que fabrican sus propios alimentos a partir de materias primas inorgánicas y por lo tanto no dependen, para su nutrición, de otros organismos. Algunas bacterias son autótrofos quimiosintéticos: son productores que fabrican sus compuestos orgánicos mediante la oxidación de sustancias inorgánicas simples como el azufre y el amoníaco. Los autótrofos quimiosintéticos no requieren de luz como fuente de energía para realizar estas reacciones. La mayor parte de los productores son autótrofos fotosintéticos: organismos que utilizan la luz como fuente de energía para la fabricación de compuestos orgánicos a partir de dióxido de carbono y agua.
Cuando se examina al microscopio una pequeña porción de la hoja de una planta, se puede comprobar que el color verde debido a la clorofila no está difundido en el citoplasma sino que se encuentra confinado en los cloroplastos, localizados principalmente en las células del mesófilo, tejido que se ubica en el interior de la hoja. De acuerdo a la especie vegetal de la que se trate, cada célula del mesófilo contiene entre 20 y 100 cloroplastos.
Si se utiliza el microscopio electrónico puede comprobarse que los cloroplastos, al igual que las mitocondrias, poseen una membrana interna y otra externa. La membrana interna encierra una zona llena de líquido, denominada estroma, que contiene la mayor parte de las enzimas necesarias para aquellas reacciones de la fotosíntesis que no requieren de luz (las reacciones que convierten el dióxido de carbono en glucosa).
Como ya se ha mencionado La membrana interna de los cloroplastos también encierra un tercer sistema de membranas que forman un conjunto de sacos discoides, aplanados e interconectados entre sí, llamados tilacoides. Estas membranas tilacoides forman un tercer compartimiento en los cloroplastos, llamado espacio tilacoideo. En algunas zonas estos sacos se organizan en columnas llamadas grana. Cada grana se parece a una pila de monedas, en donde cada moneda corresponde a un tilacoide. Algunas membranas tilacoidales se extienden de un grana a otro, conformando un sistema interconectado. Los procariotes fotosintéticos como las cianobacterias carecen de cloroplastos, pero poseen tilacoides que se presentan como extensiones de la membrana celular y se ubican en la periferia de la célula. La clorofila, los pigmentos fotosintéticos y las enzimas necesarias para las reacciones de la fotosíntesis que requieren luz se encuentran asociadas a las membranas tilacoidales. Estas membranas, al igual que la membrana interna de las mitocondrias intervienen en la síntesis de ATP.
FOTOSÍNTESIS: CAPTACIÓN DE ENERGÍA LUMINOSA
Los organismos fotosintéticos atrapan la luz solar formando ATP y NADPH, que utilizan como fuente de energía para fabricar glúcidos y otros componentes orgánicos a partir de CO2 y H2O. Los heterótrofos aeróbicos usan el O2 para degradar los productos orgánicos ricos en energía producidos en la fotosíntesis a CO2 y H2O, generando ATP para sus propias actividades. El CO2 formado regresa a la atmósfera para volver a ser utilizado por los organismos fotosintéticos. De este modo la energía solar proporciona la fuerza motriz para la ciclación continua del CO2 y O2 atmosféricos.
La ecuación global de la fotosíntesis describe
una reacción de óxido-reducción en la que el H2O provee el hidrógeno
necesario para la reducción del CO2 a glúcidos (CH2O),
con liberación de oxígeno molecular:
luz
H2O + CO2 ![]() (CH2O)
+ O2
(CH2O)
+ O2
La fotosíntesis abarca dos procesos: las
reacciones luminosas (etapa clara), que sólo tienen lugar cuando se
iluminan las plantas, y las reacciones de fijación de carbono, mal llamadas reacciones
oscuras (etapa oscura), ya que tienen lugar tanto en la luz como en la
oscuridad (sería más correcto denominarlas reacciones fotoindependientes). En
las reacciones luminosas se absorbe energía luminosa por parte de la clorofila
y otros pigmentos, conservándola en forma química mediante dos productos ricos
en energía: ATP y NADPH. En las reacciones de fijación de carbono se utilizan
el ATP y el NADPH para reducir el CO2, formando glucosa y
otros productos orgánicos.
¿De qué manera los pigmentos de las membranas
tilacoides transforman las moléculas de la energía luminosa en energía química?
La
clave la dio un descubrimiento realizado en 1937 por Robert Hill, que demostró
que cuando se exponen a la luz extractos de hoja que contienen cloroplastos en
presencia de un aceptor de hidrógeno (A) se desprende oxígeno, al tiempo que
tiene lugar la reducción simultánea del aceptor de hidrógeno, según una
ecuación actualmente conocida como reacción de Hill.
2 H2O + 2 A ![]() 2
AH2 + O2
2
AH2 + O2
El aceptor de hidrógeno utilizado por Hill
fue el diclorofenolindofenol, que en su forma oxidada es azul y en su forma
reducida es incolora. Cuando se iluminaba el recipiente con la mezcla de
reacción, el colorante se decoloraba y se formaban burbujas de oxígeno. En la
oscuridad no había reacción. Hill también demostró que la presencia de CO2
no es necesaria para que la reacción tenga lugar y que si está presente no es
afectado en la reacción, concluyendo que la producción de oxígeno podía
disociarse de la reducción del CO2. Algunos años más tarde se
encontró que el aceptor universal en las plantas es el NADP+, un
análogo fosforilado del NAD+:
2 H2O + 2 NADP+ ![]() 2
NADPH + 2 H+ + O2
2
NADPH + 2 H+ + O2
En la fotosíntesis, los electrones fluyen desde el agua hacia el NADP+ , en tanto que en la fosforilación oxidativa que ocurre en la cadena respiratoria que tiene lugar en las mitocondrias sucede lo contrario: los electrones pasan del NADH al O2, con formación de agua. Puesto que el flujo electrónico inducido por la luz va “cuesta arriba” no puede transcurrir sin aporte de energía. Esta energía proviene de la luz.
La absorción de luz excita las moléculas
La luz es una pequeña parte de un gran espectro de radiación, el espectro electromagnético. Todas las radiaciones de dicho espectro viajan a través de ondas. En un extremo del espectro se encuentran los rayos gamma, cuya longitud de onda es muy corta (menor de un nanómetro). La longitud de onda es la distancia que existe entre la cresta de una onda y la de la siguiente. En otro extremo del espectro se encuentran las ondas de radiación de baja frecuencia, cuya longitud de onda es tan grande que puede medirse en kilómetros.
Los diferentes colores de la luz (distintas regiones del espectro de luz) se identifican mediante sus longitudes de onda. Dentro del espectro de la luz visible el color violeta corresponde a la longitud de onda más corta y el rojo a la longitud de onda más larga. La luz ultravioleta tiene una longitud de onda aún más pequeña y el infrarrojo una longitud de onda incluso mayor. La luz no sólo se comporta como una onda, sino también como una partícula. Está constituida por pequeños paquetes de energía llamados fotones. La luz visible es radiación electromagnética de longitud de onda entre 400 y 700 nm. La energía de un fotón (cuanto de luz) es mayor cuanto menor sea la longitud de onda y va de 300 kJ (radiación violeta de 400 nm de longitud de onda) a 170 kJ (radiación roja de 700 nm de longitud de onda). En otras palabras, la energía de un fotón es inversamente proporcional a su longitud de onda.
|
Color |
Rango
de longitud de onda (nm) |
Energía
(KJ/mol) |
|
Ultravioleta |
<400 |
471 |
|
Violeta |
400-425 |
292 |
|
Azul |
425-490 |
260 |
|
Verde |
490-560 |
230 |
|
Amarillo |
560-585 |
210 |
|
Anaranjado |
585-640 |
193 |
|
Rojo |
640-740 |
176 |
|
Infrarrojo |
>740 |
85 |
La capacidad de una molécula para absorber luz depende del ordenamiento de sus electrones alrededor de los núcleos atómicos en su estructura. Cuando se absorbe un fotón se eleva un electrón a un nivel energético superior, pero el proceso ocurre según un sistema de todo o nada: para ser absorbido el fotón ha de contener una cantidad de energía (un cuanto) que iguale exactamente la energía de la transición electrónica. Una molécula que ha absorbido un fotón se encuentra en estado excitado que, en general, es inestable. Los electrones elevados a orbitales de energía superior usualmente vuelven rápidamente a sus orbitales normales (estado basal), dejando ir el cuanto de energía en forma de luz (fluorescencia) y/o calor. La radiación fluorescente es siempre de mayor longitud de onda (menor energía) que la luz absorbida.
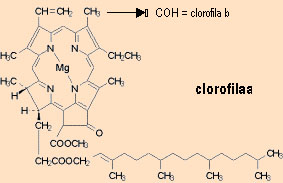 Pigmentos fotosintéticos
Pigmentos fotosintéticos
Los más importantes son las clorofilas, pigmentos verdes con estructuras policíclicas que se parecen a la protoporfirina de la hemoglobina, excepto que la posición central está ocupada por el Mg2+ en lugar del Fe2+. La molécula está compuesta de cuatro anillos pirrólicos sustituidos y un quinto anillo no pirrólico. Además contiene una larga cadena hidrofóbica de un alcohol, el fitol, esterificando a un ácido sustituyente de uno de los pirroles. El sistema de anillos heterocíclicos tiene una estructura poliénica extendida con alternancia de enlaces sencillos y dobles (conjugados) que constituyen el grupo cromóforo responsable de la absorción de luz. Los cloroplastos de las plantas superiores contienen siempre dos tipos de clorofila. Una es invariablemente la clorofila a, mientras que la segunda es en muchas especies la clorofila b, que sólo difiere de la clorofila a en que tiene un grupo aldehido en lugar de un grupo metilo en el anillo II. La mayoría de las plantas superiores contienen aproximadamente el doble de clorofila a que de clorofila b.
Además de las clorofilas, las membranas
tilacoidales contienen pigmentos secundarios que también absorben la luz,
llamados conjuntamente pigmentos accesorios. Los carotenoides incluyen a los
carotenos, no oxigenados, y a las xantofilas, de colores rojo al amarillo. Las
ficobilinas son pigmentos tetrapirrólicos pero no cíclicos, presentes en algas
rojas y en cianobacterias e incluyen a la ficocianina (azul) y a la
ficoeritrina (roja).
Espectro de acción de la fotosíntesis
El espectrofotómetro es un instrumento para
medir la cantidad de luz que puede absorber una sustancia, por lo que da idea
de la capacidad de los distintos pigmentos para absorber diferentes longitudes
de ondas luminosas. Sin embargo, un espectro de absorción no indica cuáles son
las longitudes de onda más efectivas para la fotosíntesis. La efectividad relativa
de las diferentes longitudes de onda en la fotosíntesis está dada por el
espectro de acción de la fotosíntesis, que fue determinado en un experimento
biológico clásico. En 1833 el biólogo alemán T.W. Engelmann, aprovechando la
forma del cloroplasto en
¿Cómo medir la fotosíntesis en aquellos días
de tecnología tan elemental? Engelmann sabía que durante la fotosíntesis se
producía oxígeno, y que algunas bacterias tenían especial atracción por áreas
de alta concentración de oxígeno. Por tanto, determinó el espectro de acción
observando hacia cuáles células de Spirogyra nadaban estas bacterias y
encontró que se dirigían a las localizadas en las regiones azul y roja del
espectro. El hecho de que las bacterias no se dirigiesen hacia esas zonas en
ausencia de
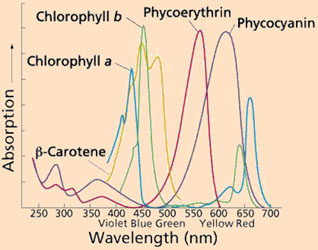 Sin embargo, el espectro de acción de la
fotosíntesis difiere un poco del espectro de absorción de la clorofila pura, en
particular en las plantas de colores fuertes. Esto se explica en dos partes:
primero, los cloroplastos contienen pigmentos accesorios, como carotenoides y
ficobilinas (pigmentos accesorios de algas rojas y de cianobacterias) en
cantidades tan grandes que ocultan el color de la clorofila y, por tanto,
absorben la luz verde que la clorofila reflejaría; segundo, y más
específicamente, estos pigmentos accesorios transfieren su energía de
excitación de la luz verde a las moléculas de clorofila. La presencia de estos
pigmentos permite a las algas utilizar con mayor eficacia la luz verde del
espectro, en comparación, por ejemplo, con los crisantelmos. Esto constituye un
importante mecanismo de adaptación, ya que permite que las algas vivan en
hábitats acuáticos profundos, en donde la luz roja tan efectiva para la
fotosíntesis ha sido absorbida durante el paso de la luz a través del agua.
Sin embargo, el espectro de acción de la
fotosíntesis difiere un poco del espectro de absorción de la clorofila pura, en
particular en las plantas de colores fuertes. Esto se explica en dos partes:
primero, los cloroplastos contienen pigmentos accesorios, como carotenoides y
ficobilinas (pigmentos accesorios de algas rojas y de cianobacterias) en
cantidades tan grandes que ocultan el color de la clorofila y, por tanto,
absorben la luz verde que la clorofila reflejaría; segundo, y más
específicamente, estos pigmentos accesorios transfieren su energía de
excitación de la luz verde a las moléculas de clorofila. La presencia de estos
pigmentos permite a las algas utilizar con mayor eficacia la luz verde del
espectro, en comparación, por ejemplo, con los crisantelmos. Esto constituye un
importante mecanismo de adaptación, ya que permite que las algas vivan en
hábitats acuáticos profundos, en donde la luz roja tan efectiva para la
fotosíntesis ha sido absorbida durante el paso de la luz a través del agua.
La clorofila canaliza la energía absorbida a centros de reacción fotoquímicos
Los pigmentos de las membranas tilacoidales que absorben luz están ordenados en conjuntos o dispositivos funcionales denominados fotosistemas. En los cloroplastos de espinaca cada fotosistema contiene unas 200 moléculas de clorofilas y unas 50 de carotenoides. Todas las moléculas de pigmentos pueden absorber fotones, pero sólo unas pocas pueden transducir la energía luminosa a energía química. Un pigmento transductor consiste en varias moléculas de clorofila combinadas con un complejo proteico que también contiene quinonas fuertemente unidas; este complejo se denomina centro de reacción fotoquímico. Las otras moléculas del fotosistema se denominan moléculas recolectoras de luz o antenas. Su función es absorber energía lumínica y transmitirla a velocidad muy elevada al centro de reacción en donde tienen lugar las reacciones fotoquímicas que se describirán más adelante.
Las moléculas de clorofila en las membranas tilacoidales están ligadas a proteínas integrales de membrana (fijadoras de clorofila a o b, o proteínas CAB) que orientan a la clorofila con respecto al plano de la membrana y le confieren propiedades para la absorción de la luz ligeramente diferentes de las de la clorofila libre. Cuando una molécula de clorofila (o un pigmento accesorio) absorbe un fotón se excita y en lugar de emitir fluorescencia- transfiere la energía por resonancia a una molécula de clorofila vecina y retorna a su estado basal. El proceso se repite varias veces hasta que se excita la clorofila del centro de reacción, donde se promueve el pasaje de un electrón a un orbital de energía superior, de donde finalmente es cedido a un aceptor electrónico vecino que forma parte de la cadena de transportadores de electrones y que darán como resultado final la generación de ATP y de NADPH.
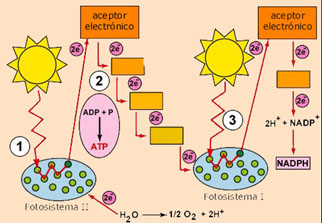 Las membranas tilacoides tienen
dos tipos de fotosistemas, cada uno de ellos con su centro de reacción y su
conjunto de moléculas antena. Los dos fotosistemas tienen funciones distintas y
complementarias. El fotosistema I tiene un centro de reacción denominado P700 y
una elevada proporción de clorofila a en relación con la clorofila b. El
fotosistema II, con su centro de reacción P680, contiene cantidades
aproximadamente iguales de ambas clorofilas y puede tener también clorofila c.
Todas las plantas superiores, algas y cianobacterias tienen ambos fotosistemas,
pero las bacterias fotosintéticas, que no desprenden oxígeno, sólo tienen el
fotosistema I.
Las membranas tilacoides tienen
dos tipos de fotosistemas, cada uno de ellos con su centro de reacción y su
conjunto de moléculas antena. Los dos fotosistemas tienen funciones distintas y
complementarias. El fotosistema I tiene un centro de reacción denominado P700 y
una elevada proporción de clorofila a en relación con la clorofila b. El
fotosistema II, con su centro de reacción P680, contiene cantidades
aproximadamente iguales de ambas clorofilas y puede tener también clorofila c.
Todas las plantas superiores, algas y cianobacterias tienen ambos fotosistemas,
pero las bacterias fotosintéticas, que no desprenden oxígeno, sólo tienen el
fotosistema I.
La absorción de luz por el fotosistema
II inicia el proceso .......
Cuando la energía de excitación llega al centro de reacción del fotosistema II, se genera una molécula de potencial de reducción muy negativo, el P680*, que finalmente cede su electrón a una serie de quinonas (plastoquinona y otras), que son capaces de tomar protones del medio. Para poder continuar con el proceso, el P680+ debe adquirir un electrón para volver a su estado basal. Ese electrón podría provenir de un gran número de compuestos orgánicos o inorgánicos, pero el gran salto evolutivo lo dieron los antecesores de las cianobacterias, que adaptaron el fotosistema II para aprovechar los electrones de agua, el producto más abundante que existía. Para ello crearon un complejo de escisión del agua, que contiene cuatro iones manganeso. La absorción secuencial de cuatro fotones, cada uno de los cuales produce la pérdida de un electrón del centro de Mn, produce un agente oxidante que está en condiciones de tomar cuatro electrones del agua, generando cuatro protones y una molécula de oxígeno.
La absorción de luz por el fotosistema I crea un poderoso agente reductor
 Los procesos fotoquímicos que ocurren en el
fotosistema I son similares a los que se han indicado para el fotosistema II.
La captura de un fotón por una de las moléculas antena y su traslado hasta el
P700 origina una molécula excitada (P700*) que transfiere su electrón a una
serie de aceptores entre quienes se encuentran una proteína hierro-sulfurada
(Fe-S), la ferredoxina (Fd) y finalmente la ferredoxina-NADP+oxidorreductasa,
que transfiere los electrones al NADP+ para formar NADPH. Como
consecuencia de la cesión de un electrón, la molécula de P700 ha quedado con
déficit electrónico (P700+), el que es satisfecho porque una
proteína soluble que contiene cobre y que pertenece al fotosistema II
(plastocianina) le cede sus electrones.
Los procesos fotoquímicos que ocurren en el
fotosistema I son similares a los que se han indicado para el fotosistema II.
La captura de un fotón por una de las moléculas antena y su traslado hasta el
P700 origina una molécula excitada (P700*) que transfiere su electrón a una
serie de aceptores entre quienes se encuentran una proteína hierro-sulfurada
(Fe-S), la ferredoxina (Fd) y finalmente la ferredoxina-NADP+oxidorreductasa,
que transfiere los electrones al NADP+ para formar NADPH. Como
consecuencia de la cesión de un electrón, la molécula de P700 ha quedado con
déficit electrónico (P700+), el que es satisfecho porque una
proteína soluble que contiene cobre y que pertenece al fotosistema II
(plastocianina) le cede sus electrones.
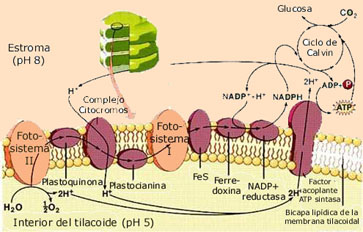
El complejo de los citocromos une los fotosistemas II y I
Los electrones almacenados en las quinonas
del fotosistema II se transportan al P700 del fotosistema I a través del
complejo de los citocromos y de la plastocianina. El complejo de los citocromos
es muy similar al complejo III de la cadena respiratoria: recibe electrones de
una quinona y se los cede a una proteína soluble (la plastocianina, en el
cloroplasto, en lugar del citocromo c de las mitocondrias). Al igual que en la
mitocondria, también se bombean protones, pero en este caso desde el estroma
hacia el interior del espacio tilacoidal. Dado que este espacio es pequeño, la
entrada de un número reducido de protones tiene un efecto pronunciado, que
alcanza a 3 unidades de pH (pH 8 el estroma, pH 5 el espacio tilacoidal), con
lo que la concentración de protones interna es 3000 veces superior a la del
estroma, generando una importante fuerza motriz para la síntesis de ATP.
Acoplamiento de la síntesis de ATP al flujo de electrones impulsado por la luz
En 1954 Arnon descubrió que si se añadían ADP y fosfato inorgánico a la reacción de Hill, se generaba ATP, proceso al que se denominó fosforilación fotosintética, o simplemente fotofosforilación, para distinguirla de la fosforilación oxidativa que se produce durante la respiración mitocondrial. A diferencia de lo que ocurre con respiración mitocondrial, no está bien establecida la estequiometría del proceso, pero se estima que por cada par de electrones transportados se forman una o dos moléculas de ATP.
La enzima responsable de la síntesis de ATP
en los cloroplastos es un complejo muy similar a de las mitocondrias: CF0
es una proteína transmembrana que permite el pasaje de protones homóloga a
Síntesis fotosintética de glúcidos
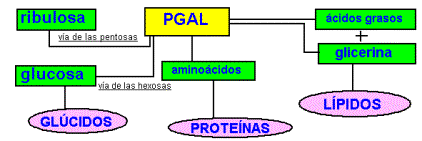
Las plantas verdes contienen en sus cloroplastos una maquinaria enzimática única para catalizar la conversión del CO2 en compuestos orgánicos sencillos (reducidos), proceso que se denomina fijación del CO2 o fijación del carbono. Las reacciones que dan lugar a la fijación y reducción del dióxido de carbono forman parte de una ruta cíclica elucidada a principios de la década del ‘50 por Melvin Calvin y a menudo se la denomina ciclo de Calvin.
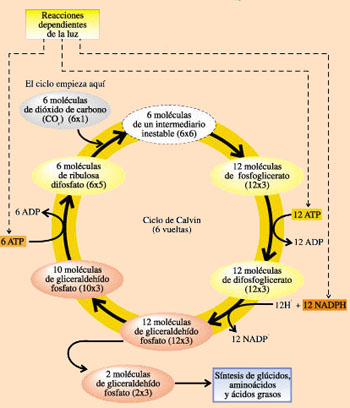 La fijación del CO2 tiene lugar en
tres fases:
La fijación del CO2 tiene lugar en
tres fases:
1. Fijación del CO2 en una unión orgánica , lograda a través de la condensación de seis moléculas de dióxido de carbono con otras tantas de una pentosa, la ribulosa 1,5-difosfato, formando seis moléculas de un intermediario inestable que se descompone en 12 moléculas de 3-fosfoglicerato
2. Reducción del 3-fosfoglicerato a gliceraldehido-3-fosfato. El poder reductor (NADPH) generado en las reacciones luminosas se utiliza para reducir las 12 moléculas de 3- fosfoglicerato a gliceraldehido-3-fosfato. De ellas, dos moléculas se utilizan en la síntesis de una molécula de glucosa-fosfato que se utilizará luego en la síntesis de almidón.
3. Regeneración de la pentosa difosfatada . Diez de las doce moléculas de gliceraldehido-3-fosfato se utilizan para la regeneración de las 6 moléculas de ribulosa-1,5-bisfosfato. De este modo el proceso cíclico permite la conversión continua de CO2 en triosas y hexosas fosfato.
Fase 1. Fijación del CO2 y conversión en 3-fosfoglicerato.
La enzima que cataliza la incorporación del CO2 en forma orgánica es la ribulosa-1,5-bisfosfato carboxilasa oxidasa (rubisco). Está constituida por ocho subunidades grandes (56 kDa c/u) y ocho subunidades pequeñas (14 kDa c/u), lo que hace un total de 560 kDa. Está localizada en el estroma del cloroplasto, donde constituye alrededor del 50% de la proteína total del cloroplasto. Es la enzima más abundante de la biosfera. La enzima cataliza la incorporación del CO2 a la ribulosa-1,5-bisfostato y la rotura del intermedio inestable de seis carbonos que se forma, generando dos moléculas de 3-fosfoglicerato.
Fase 2. Conversión de 3-fosfoglicerato en gliceraldehido-3-fosfato
Ocurre en dos pasos que básicamente significa el proceso inverso de la glucólisis. La diferencia estriba en que el cofactor necesario para la reducción es el NADPH y no el NADH. En el primer paso el 3-fosfoglicerato es convertido a 1,3-bisfosfoglicerato por la quinasa correspondiente a expensas del ATP; en el segundo la deshidrogenasa que requiere NADPH reduce al 1,3-bisfosfoglicerato a gliceraldehido-3-
|
|
fosfato con producción de fosfato inorgánico. El destino del fosfoglicerato es variado: a) la mayor parte de él se recicla para regenerar la pentosa fosfato que da inicio al proceso, b) sintetizar moléculas de glucosa fosfato (vía de las hexosas), ácidos grasos, amoinoácidos... etc; y en general todas las moléculas que necesita la célula. Como por ejemplo dar lugar a la síntesis de almidón, que se conserva en el cloroplasto . |
También puede c) abandonar el cloroplasto y dar lugar a la formación de sacarosa o degradarse mediante la vía glicolítica con producción de energía.
Fase 3. Regeneración de la ribulosa-1,5-bisfosfato a partir de triosas fosfato
Dado que la primera reacción de fijación del carbono consiste en la unión del dióxido de carbono a una pentosa difosfatada (la ribulosa-difosfato), se debe regenerar ésta constantemente para que el flujo de CO2 a glúcidos sea continuo. Para ello se forman intermedios de 3, 4, 5, 6 y 7 carbonos en un proceso que convierte triosas en pentosas. Las reacciones son las siguientes, teniendo en cuenta que en el proceso total se considera que 3 moléculas de CO2 han reaccionado con otras tantas de ribulosa-1,5-bisfosfato para dar 6 moléculas de triosa-fosfato (gliceraldehido-3-fosfato y dihidroxiacetona fosfato).
Cada glucosa fosfato sintetizada a partir de CO2 y H2O cuesta 12 NADPH y 18 ATP
El resultado neto del ciclo de Calvin es la conversión de seis moléculas de dióxido de carbono y una de fosfato en una de glucosa-6-fosfato. Para ello será necesario que se condensen 6 de ribulosa-1,5-difosfato con otras tantas de CO2 para dar un intermedio inestable (18 carbonos) que se descompone dando lugar a 12 moléculas de 3-fosfoglicerato. Estas 12 moléculas de 3-fosfoglicerato se reducen a 12 moléculas de 1,3-difosfoglicerato con el consumo de 12 ATP y luego se utilizan 12 NADPH para obtener finalmente 12 moléculas de gliceraldehido-3-fosfato.
Dos de las doce moléculas de gliceraldehido-3-fosfato son el resultado neto del proceso ; las otras diez se reordenan para formar 6 moléculas de ribulosa-5-fosfato. Falta ahora regenerar las seis moléculas iniciales, por lo que se consumen 6 ATP adicionales para pasar la ribulosa-5-fosfato a ribulosa-1,5-difosfato. La fuente de ATP y NADPH son las reacciones luminosas ocurridas en el tilacoide.
En la oscuridad cesa la producción de ATP y
NADPH, por lo que también cesa la fijación del CO2 (de allí el error
de denominar “reacciones oscuras” a las reacciones de fijación del CO2).
La glucosa-6-fosfato producida es convertida por la fosfoglucomutasa en
glucosa-1-fosfato, material de partida para la síntesis del almidón por las
fosforilasas.
Fotorrespiración
La rubisco no es específica para el CO2, ya que el O2 compite con éste por el sitio activo de la enzima. Aparentemente la evolución de la rubisco produjo un sitio activo incapaz de discriminar bien entre ambos sustratos, quizás debido a que gran parte de la evolución tuvo lugar antes de que el oxígeno fuese un componente importante de la atmósfera. El problema es que la condensación de la ribulosa-1,5-bisfoafato con el oxígeno no permite la fijación de carbono, sino que se forma un intermediario inestable oxigenado que se descompone en una molécula de 3-fosfoglicerato y otra de fosfoglicolato (de dos carbonos). A través de un proceso en el que intervienen tres organelos (el cloroplasto, el peroxisoma y la mitocondria, dos moléculas de glicolato (4 carbonos) son reconvertidas en 3-fosfoglicerato y dióxido de carbono. En el proceso total se consume oxígeno en los tres compartimientos subcelulares (cloroplasto, peroxisoma y mitocondria) y se produce dióxido de carbono, como en la respiración (de ahí el nombre de fotorrespiración), pero el proceso es energéticamente desfavorable.
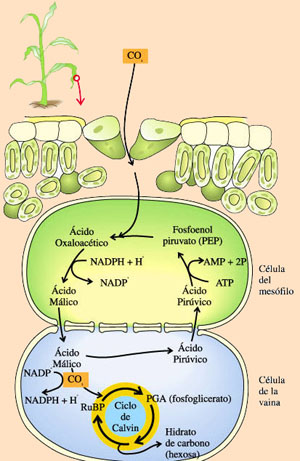 Algunas plantas tienen un mecanismo que
impide la fotorrespiración. Plantas C3 y C4
Algunas plantas tienen un mecanismo que
impide la fotorrespiración. Plantas C3 y C4
Se dice que la mayor parte de las plantas son plantas C3, porque el principal producto de la fijación del dióxido de carbono es un compuesto de tres carbonos, el 3-fosfoglicerato. Algunas plantas, llamadas plantas C4, son capaces de fijar dióxido de carbono muy eficientemente mediante la formación intermedia de un compuesto de cuatro carbonos, el oxaloacetato. De todos modos estas plantas utilizan el ciclo de Calvin para producir carbohidratos, pero primero incorporan el dióxido de carbono en el oxaloacetato.
Las plantas C4, que típicamente crecen en condiciones de altas intensidades luminosas y temperatura, tienen alta velocidad fotosintética, alta velocidad de crecimiento, baja o nula velocidad de fotorrespiración y baja velocidad de pérdida de agua. De hecho, una de las principales diferencias entre las plantas C3 y C4 es que estas últimas no se saturan, ni siquiera en presencia de las intensidades de luz más elevadas de la naturaleza. Para ello han modificado su estructura anatómica, en la que el mesófilo (tejido fotosintético) adopta una disposición “en corona” (de allí el nombre de estructura Kranz, “corona”, en alemán) que rodea a las células de la vaina del haz, que a diferencia de lo que ocurre en las plantas C3 (ver figura)son muy ricas en cloroplastos.(ver figuras) El ciclo de Calvin se realiza en las células de estas vainas y las reacciones de la vía C4 se llevan a cabo en las células del mesófilo, dando un claro significado funcional a la diferencia anatómica antes mencionada.
La característica esencial de la ruta C4 es que concentra el dióxido de carbono en la célula. El dióxido de carbono entra en la hoja a través de pequeños poros llamados estomas, los cuales se abren y cierran en respuesta a factores como el contenido de agua y la intensidad de la luz. Cuando los estomas se cierran, el abastecimiento de dióxido de carbono disminuye y en las plantas C3 la fotosíntesis disminuye de modo considerable. Las reacciones de la vía C4 incrementan la fijación de dióxido de carbono, de manera que aún en circunstancias adversas, la fotosíntesis, y por ende el crecimiento de la planta, se lleva a cabo con gran eficiencia. Entre las plantas agresivas y de crecimiento rápido que utilizan la vía C4 se encuentran la caña de azúcar, el maíz, el sorgo y la gramilla. El rendimiento de los cultivos de plantas C4 es dos o tres veces más alto que el de plantas C3. Si este mecanismo pudiera incorporarse por medios genéticos a otras especies vegetales, se podría incrementar de modo importante la producción de alimento en algunas regiones del mundo.
El cometido del ciclo C4 es
simplemente incrementar la concentración de dióxido de carbono dentro de las
células de la vaina, de modo que el ciclo C3 se verifique ahí.
La operación del ciclo C4 sirve para incrementar la concentración de
dióxido de carbono dentro de las células de la vaina vascular unas
Cuando operan conjuntamente la vía C4
y el ciclo de Calvin, la reacción neta es:
6 CO2 + 30 ATP + 12 NADPH + 18 H2O ![]() C6H12O6
+ 30 ADP + 30 Pi + 12 NADP+ + 18 H+
C6H12O6
+ 30 ADP + 30 Pi + 12 NADP+ + 18 H+
BIBLIOGRAFIA
Lehninger, A.L., D.L. Nelson y M.M. Cox
(1993) “Principios de Bioquímica”, Ediciones Omega, Barcelona, 2a edición
(traducido de la segunda edición inglesa. 1993).
Alberts, B., D. Bray,
A. Johnson, J. Lewis, M. Raff, K. Roberts y P. Walter (1998) “Essential Cell
Biology. An Introduction to the Molecular Biology of the Cell”. Garland
Publishing, Inc.,
Solomon, E.P., L. R. Berg, D.W. Martin &
C. Villee (1996) “Biología” 3ra. Edición (traducido de la tercera edición
inglesa, 1993). Interamericana McGraw-Hill, México.
Streyer, Lubert (1990) “Bioquímica”,
Editorial Reverté, Barcelona, 3ra edición
![]()