Respiración Celular
Autor: Ing. Agr. Carlos González
RESPIRACION ANAEROBICA Y AERÓBICA
El proceso a través del cual la energía de la glucosa u otra moléculas combustibles es capturada por la célula en la forma de ATP se conoce con el nombre de respiración celular. Se pueden distinguir dos tipos de respiración en la materia viviente: anaeróbica y aeróbica.
La respiración aeróbica incluye la ruptura de la glucosa a través de una serie de reacciones en las cuales finalmente interviene el elemento oxígeno. El oxígeno no reacciona directamente con las moléculas de glucosa en las células vivientes. Sin embargo es una parte importante en la reacción total de ruptura. Con excepción de ciertos microorganismos como son algunos tipos de bacterias, la respiración aeróbica ocurre en células de todos los animales y plantas. La siguiente es una ecuación general para la respiración aeróbica:
MOLECULA DE COMBUSTIBLE + 02 ------~
FRAGMENTOS DE COMBUSTIBLE + H2O + ENERGIA.
Los fragmentos de combustible de la respiración aeróbica son generalmente anhídrido carbónico.
La respiración anaeróbica ocurre en ausencia de oxígeno y es típica de muchos microorganismos. Sin embargo, las células de organismos superiores son también capaces de llevar a cabo respiración anaeróbica, cuando la cantidad de oxígeno es limitada. Las células musculares en el hombre, por ejemplo, efectúan respiración anaeróbica durante los períodos de ejercicio extenuante. E1 patrón de respiración anaeróbica se da en la siguiente ecuación :
MOLECULA DE COMBUSTIBLE ------~ FRAGMENTOS DE COMBUSTIBLE + ENERGIA.
Los fragmentos de combustible de la respiración anaeróbica son C02 y ya ácido láctico (C3H603) o alcohol etílico (C2HSOH), dependiendo del tipo célula en las cuales ocurre el proceso.
Los principios químicos sobre los cuales operan las respiraciones anaeróbica y aeróbica son similares. Ambos procesos son exergónicos y por lo tanto «ruedan cuesta abajo»; ambos tienen lugar en una serie de reacciones químicas que realizan por pasos; ambos envuelven reacciones de oxidación y reacciones reducción. La oxidación comprende la eliminación de electrones de un átomo de una molécula, mientras que la reducción comprende su adición a un átomo a una molécula. En las células vivientes, la energía se gana separando electrones dos a la vez, de moléculas de combustible como la glucosa.
El proceso clave de liberación de energía tanto en la
respiración aeróbica como anaeróbica, es el transporte de electrones desde la
molécula de combustibles a un aceptor de electrones. La molécula de combustible
se oxida; el aceptor reduce. A medida que los electrones se transfieren caen
desde niveles de energía más altos a niveles de energía más bajos. La energía
que pierden al caer se incorpora a los enlaces fosfato de alta energía. Este
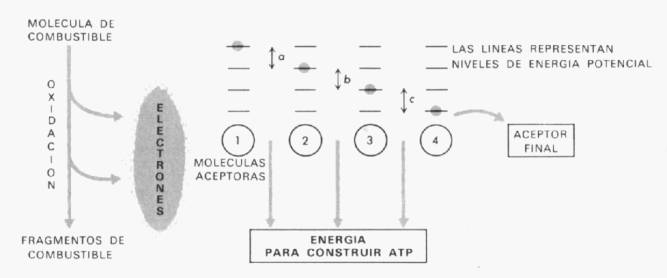
proceso, de gran importancia, está diagramado en
|
Fig. 1-1. Diagrama
general que muestra el principio relacionado con las oxidaciones biológicas y
el almacenamiento de energía en la forma de ATP. Las estructuras circulares
marcadas de En todas las células
vivientes, la energía de las moléculas de combustible se captura a través del
proceso de transferencia de electrones. El mecanismo liberador de energía es
la caída en los niveles de energía potencial de los electrones. Una mayor compresión de
la complejidad y eficiencia de los sistemas moleculares se puede obtener al
examinar detalladamente los procesos de respiración anaeróbica y aeróbica. E1
estado inicial, llamado glucólisis, o fermentación, es el mismo
para ambos tipos de respiración. El segundo estado, conocido como ciclo del ácido
cítrico de Krebs es característico de la respiración aeróbica. |
Glucólisis:
La primera fase de la degradación de un combustible celular ordinario como la glucosa se debe a una vía metabólica llamada glucólisis (también conocida como vía de Embden·Meyefiof en honor de sus descubridores). Un hecho interesante es que la glucólisis siendo globalmente un proceso oxidativo, no hay intervención de oxígeno molecular. Por tanto, se trata de un proceso anaeróbico que quizá satisfizo las necesidades de las células mucho antes de que la atmósfera terrestre tuviera oxígeno molecular. A partir de ello, hoy se puede afirmar que ésta molécula combustible básica es tan útil para la respiración aeróbica como para la respiración anaeróbica.
Por otra parte, este monómero, una vez introducido en una célula, puede:
a- generar energía (ATP),
b- suministrar monómeros para las reacciones biosintética, por ejemplo: formación de ac grasos de cadena larga , o
c- ser precursor de polímeros con capacidad de ser almacenados tanto en individuos vegetales, animales y procariontes.
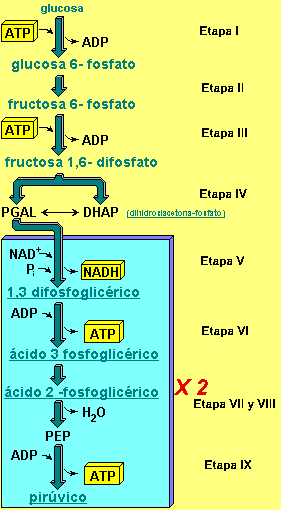
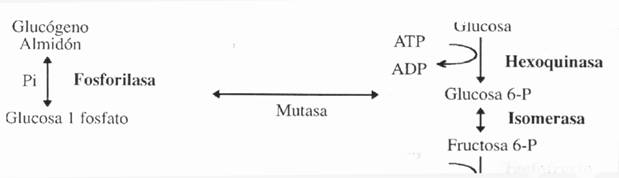
Los principales fenómenos que caracterizan a la glucólisis se encuentran resumidos en el siguiente Fig. 1.2 y son:
|
Fig. 1.2 |
Etapa I: Fosforilación de la glucosa Etapa II: Isomerización de la fructosa Etapa III: Fosforilación de la fructosa Etapa IV: Ruptura de la fructosa Etapa V: Oxidación y formación de enlace fosfato de alta energía Etapa VI: Generación de ATP Etapa VII y VIII: Reordenamiento molecular Etapa IX: Generación de ATP Ahora, para dilucidar el por qué de cada una de las etapas se debe tener en cuenta que: §
La
velocidad para regular el pasaje de una molécula de glucosa a dos moléculas
de ácido pirúvico, está controlado por la célula para cumplir con las
funcione necesarias. §
En las vías
metabólicas, las enzimas que catalizan reacciones esencialmente irreversibles
son posibles puntos de control. §
Las tres
enzimas catalíticas y reguladoras que presentan caracteres de control son: hexoquinasa, fosfofrutoquinasa
y piruvato quinasa. |
Etapas y enzimas:
Primera Etapa: Fosforilación de la glucosa
Para separar electrones
de la glucosa, la molécula debe ser activada. Generalmente, ésta es una
molécula estable y debe impulsarse para que sobrepase la barrera de energía. La
activación se lleva a cabo cuando la célula gasta un grupo de fosfato de un ATP
transfiriéndolo a la molécula glucosa. Esto hace que dicha molécula por un lado
sea enmascarada, evitando su salida de la célula (por algún sistema de
transporte a través de la membrana plasmática) y por otro dejándola altamente
inestable. La enzima que cataliza la fosforilación de la glucosa es la hexoquinasa, la cual se comporta como Mg dependiente y se inhibe por exceso de glucosa 6-P.
|
¿Por qué? la hexoquinasa no es cuello
de botella. En el hígado se sigue fosforilándo a glucosa
6-P, a pesar de estar en exceso, gracias a una glucoquinasa que se activa cuando la concentración de
glucosa es alta, derivando a la glucosa 6-P para la síntesis de glucógeno (esta enzima le confiere al cerebro y a los músculos la
glucosa cuando ésta no abunda demasiado)o bien oxidarse en la vía de
las pentosas para generar NAPH. |
Segunda Etapa:
Esta etapa se produce la isomerización de la molécula glucosa 6-P a través de una enzima llamada fosfoglucoisomerasa, la transformación da como producto otra molécula fructosa 6-P. En esta reacción no se requiere cofactor.
Tercer Etapa:
La activación de la fructosa 6-P se lleva a cabo cuando la célula gasta por segunda vez un grupos de fosfato de un ATP transfiriéndolo a la molécula. Esto hace que dicha molécula permanezca altamente inestable. La enzima que cataliza la fosforilación de la fructosa 6-P, es la fosfofrutoquinasa (PFK), produciendo una molécula de fructosa 1-6 bi-P. Como en la gran mayoría de la quinasas esta enzima es Mg dependiente.
|
reacción [ATP] bajo
[ATP] alto
[fructosa 6-P] Fig.
1.3 |
Esto último evita la excesiva formación de
lactato y una caída brusca del pH sanguíneo (acidosis). También es inhibido
por el citrato,
el cual potencia el efecto inhibitorio del ATP. |
|
La mayor actividad enzimática se da cuando la relación ATP/ADP disminuye. |
En esta etapa existen otros reguladores de la velocidad a través de un controlador enzimático: La 2-fosfofrutoquinasa (2PFK).
Cuando la fructosa 6 fosfato comienza a acumularse, por la inhibición alostérica producida en la enzima PFK, una enzima alternativa la 2-fosfofrutoquinasa (2PFK).produce altas concentraciones de un compuesto químico llamado fructosa 2,6 bifosfato, la que, a su vez, dependiendo del contenido de glucosa en la célula, tendrá dos opciones a seguir; si la concentración de glucosa es alta desarrollará una “activación alostérica” sobre PFK, disminuyendo el efecto alostérico del ATP. Esto significa que aumenta la fructosa 1,6 bifosfato, restableciéndose la actividad glucolítica. Por el contrario si la concentración de glucosa es baja, la 2PFK, esta se transforma en fructosa 1-6 bifosfatasa, que hidroliza a la fructosa 2-6 bifosfato transformándola nuevamente en fructosa 6 fosfato. A este tipo de proceso se lo denomina estimulación hacia adelante (fig.1.4).
|
F.6-P P F.1-6 bi Fosfatasa 2 PFK PFK sin con
ATP Glucosa activación
Alosterica
F.2-6 bi-P
F. 1-6 bi-P Fig. 1.4 Enzimas en Tanden o estimuladores hacia delante |
Cuarta Etapa:
En esta etapa se obtiene dos triosas, por la escisión de la hexosa formada en la etapa anterior. Esta reacción es catalizada por la enzima aldolasa que produce dos compuestos isómeros: uno es la dihidroxiacetona (PDHA) y el otro es un gliceraldehido (PGAL). El 96 al 98 % de los isómeros presenta características de cetona; los restantes tienen características de aldehído.
La triosa cetónica es convertida en su isómero, el PGAL, por la enzima isomerasa. Esta reacción es muy rápida y reversible.
Quinta Etapa:
Hasta aquí no se ha obtenido energía de la oxidación de la glucosa. Por el contrario, se han “gastado” moléculas de ATP. Llegamos ahora a una serie de pasos que van a recolectar parte de la energía contenida en el , fosfogliceraldehído.
Como mencionamos anteriormente, las oxidaciones se pueden definir como la pérdida de protones o electrones por parte de una molécula, o directamente como la salida de átomos de hidrógeno de un compuesto.
En uno de los pasos claves de la glucólisis, el fosfogliceraldehído es oxidado por la enzima deshidrogenasa y su correspondiente coenzima, el NAD+, que se reduce a NADH. La energía que se libera durante esta oxidación, es utilizada para “atrapar” un grupo fosfato del citoplasma circundante, y fijarlo como un fosfato de alta energía. Se forma así el 1,3- ácido difosforoglicérico.
En esta etapa se puede mencionar otras vías de regulación como ser, la disponibilidad de la coenzima NAD+ , la cual juega un papel muy importante en la oxidación del fosforogliceraldehído. Esta es la primera reacción de oxidorreducción en la cual se logra captar energía disponible para la célula y formar un enlace fosfato de alta energía y una molécula de NADH. De esta manera, la presencia o ausencia de NAD+ determina que dicha etapa como otras a lo largo de la respiración celular se produzcan o no.
Otra regulación depende de la presencia de fósforo
inorgánico en el citoplasma. Por ejemplo, en ciertas condiciones edáficas
particulares, en las que el ion fosfato es muy difícil de ser captado por las
plantas, éste puede llegar a actuar como factor limitante del proceso
glucolítico. Recordemos la importancia que tiene este elemento en la formación
de la molécula de ATP.
Sexta Etapa:
En este paso se produce la transferencia de un grupo fosfato del 1,3- ácido bifosforoglicérico al ADP, con lo que se consigue la primera ganancia real de ATP del proceso de glucólisis. Así se forma ATP y una triosa con un sólo grupo fosfato, el ácido 3-fosfoglicérico. Esta reacción es catalizada por una enzima llamada fosfoglicerato quinasa.
Séptima y Octava Etapa:
La etapa se caracteriza por un reordenamiento de los átomos de la triosa, de manera que su fosfato pasa a una posición que representa -para la molécula- un enlace de alta energía. La reacción está catalizada por dos enzimas la mutasa y la enolasa.
§
La mutasa es
una enzima que cataliza un cambio intramolecular de un grupo químico como el
fosforilo.
§
La enolasa
cataliza la formación de fosfoenolpiruvato. Es una reacción de deshidratación
que eleva el potencial de transferencia del grupo fosforilo.
Novena Etapa:
Una vez logrado el reordenamiento en la etapa anterior, el fosfato de alta energía es transferido, como en la sexta etapa, a una molécula de ADP que se transforma en ATP obteniéndose, además ácido pirúvico. Esta reacción es catalizada por la piruvato quinasa. Esta enzima es de carácter alostérico, muy importante en los mamíferos.
Existe tres tipos de piruvato quinasa llamadas genéricamente isoenzimas (tienen la misma organización estructural y el mismo mecanismo catalítico, pero difieren en su regulación): la forma L (en el hígado), la forma M (en los músculos y cerebro) y la forma A en los demás tejidos. La isozima L, se inhibe por altas concentración de ATP y alanina y se activa por la fructosa-1,6 bi P y presencia ADP.
El beneficio neto, en términos de energía, partiendo de la glucosa, es 2 ATP. Pero se debe tener en cuenta que la célula ya sea vegetal o animal, no necesariamente puede partir de dicha hexosa sino que lo pude hacer desde el polímetro de ella como ser el almidón o glucógeno. Estas arquitecturas ramificadas, pueden ser degradadas por la acción complementarias de dos enzimas que liberan los monómeros, uniéndolos a fosfatos inorgánicos para originar la glucosa 1- - fosfato. Este compuesto es sumamente lábil y se transforma, por acción de la enzima mutasa en glucosa-6-fosfato.
|
Fig.
1.5 |
Luego el proceso continua por la vía glucolítica
normal, pero con una diferencia sustancial, el producto final de energía son 3ATP
(Fig. 1.5). |
La secuencia de reacciones, que se da en el citoplasma, desde la glucosa hasta el ácido pirúvico es igual en todos los organismos y en todas las células. Sin embargo, el destino del piruvato obtenido en la glucólisis es variable; depende de la presencia o ausencia de oxígeno molecular, y del tipo de metabolismo del organismo de que se trate. Los caminos a seguir son:
1-
Fermentación
2- Respiración
anaerobia
3- Respiración
aeróbica
1- Fermentación:
En condiciones anaeróbicas, los caminos posibles son varios: se puede producir fermentación alcohólica, láctica, butírica o succínica, entre otras. Desarrollaremos las dos primeras vías mencionadas, por tratarse de las más comunes en la naturaleza, aunque las otras no son menos importantes.
La fermentación al igual que la glucólisis se da en citoplasma celular. En casi todas las plantas, hongos y algunas bacterias, el ácido pirúvico puede reaccionar con el hidrógeno y formar alcohol etílico. En cambio, en los animales y en otras bacterias, el piruvato formado en la glucólisis es utilizado para formar ácido láctico. Es importante destacar que en ninguno de los dos procesos hay ganancia de energía. Surge entonces la siguiente pregunta:
¿Por qué se producen
estos procesos luego de la formación del piruvcxto, si en ellos no hay ganancia
de ATP?
Reflexionemos...
La respuesta a este interrogante es central para comprender de qué manera se interrelacionan las diferentes vías metabólicas.
Sabemos que la glucólisis produce ácido pirúvico como producto final. Durante el único paso oxidativo de esta vía, en que el fosforogliceraldehído se convierte en áeido difosforoglicérico, un NAD+ es reducido a NADH.
Para que la
glucólisis pueda continuar ese NAD+ debe ser regenerado
continuamente por oxidación del NADH.
a)
Alcohólica:
§
Se cataliza a
través de dos enzimas una descarboxilasa y luego una alcohol
deshidrogenasa (la cual es Zn dependiente).
|
Glucosa
+ 2 Pi + 2 ADP + 2 H+ --à 2 etanol + 2 CO2 + 2 ATP + 2 H2O 2 ácidos pirúvicos + 2
NADH -----à 2 alcohol etílico + 2 CO2 + 2
NAD+ |
b)
Láctica:
§
La lactato
deshidrogenasa cataliza la formación de ác. láctico.
|
Glucosa
+ 2 Pi + 2 ADP -----à 2 lactato + 2 ATP + 2 H2O 2
ácidos pirúvicos + 2 NADH --à 2 ácido láctico + 2 NAD+ |
En los organismos animales superiores, solamente las células musculares pueden sobrevivir un corto tiempo con baja concentración de oxígeno, ya que sustituyen la respiración aeróbica, por la vía fermentativa láctica. Como consecuencia de este proceso, se acumula en ellas ácido láctico, produciendo fatiga muscular que se manifiesta en forma de calambres. El ácido láctico acumulado acidifica la sangre, estimulando la respiración e, indirectamente, provoca un incremento en la frecuencia respiratoria. De este se favorece el aporte de oxígeno a las células y se puede retomar la vía aeróbica. Al cabo de un tiempo relativarnente corto, el ácido láctico acumulado comienza a oxidarse para convertirse nuevamente en glucosa, por otra vía llamada ciclo de Cori.
Ciclo de Cori:
Durante la contracción muscular en condiciones anaerobias, el lactato es un callejón sin salida en el metabolismo.


![]() Glucosa
Glucosa
Glucosa
Glucosa
![]()
![]()
![]() Gluconeogénesis
Glucolisis
Gluconeogénesis
Glucolisis
![]()
6-P 2-P
Piruvato Sangre Piruvato
![]()
![]()
![]() Lactato
Lactato
Lactato
Lactato
Baja proporción Alta proporción
NADH/NAD
NADH/NAD
Hígado
Músculo
c)
Respiración
Aeróbica (propio de la
mitocondria):
§
Descarboxilación
oxidativa del piruvato catalizada por el complejo
enzimatico piruvato deshidrogenasa.
§
Se produce en
la matriz mitocondrial.
|
Piruvato
+ CoA + NAD ----à acetil -CoA + CO2 + NADH |
§
Enzimas del
complejo:
Piruvato deshidrogenas (a)
Dihidripoil-transacetilasa
(b)
Dihidrolipoil-
deshidrogenasa ©
§
El complejo
enzimático trabaja a un pH
§
Las enzimas
del complejo se asocian espontáneamente (autoensamblaje).
§
La gran proximidad
de las enzimas que conforman el complejo enzimático, aumenta la velocidad de
reacción total y reducen las reacciones colaterales.
Regulación del complejo Piruvato deshidrogenasa:
§
En los
animales la reacción química desde piruvato hasta Acetil-CoA es irreversible.
§
Un aumento de
acetil-CoA o de NADH inhiben el complejo enzimático (el Acetil-CoA a la enzima “b” y el NADH a la enzima “c”). Y se activa por el NAD y por el
CoA.
§
Con un
aumento de GTP, el complejo reduce su actividad. En cambio si se activa, en
presencia de AMP.
§
La última
regulación se logra por una fosforilación reversible:
C.E. se inactiva
cuando:
El ATP fosforila a
través de una quinasa un residuo de serina de la enzima “a”. Esta fosforilación se favorece cuando el NADH, el aceti-CoA o
el ATP se encuentran en altas proporciones. En cambio se inhibe por alta
porcentaje de piruvato.
C.E. se activa
nuevamente: cuando una fosfatasa específica hidroliza el grupo fosforilo. Esto
se favorece aun más con altas [Ca] o alto contenido de insulina en sangre.
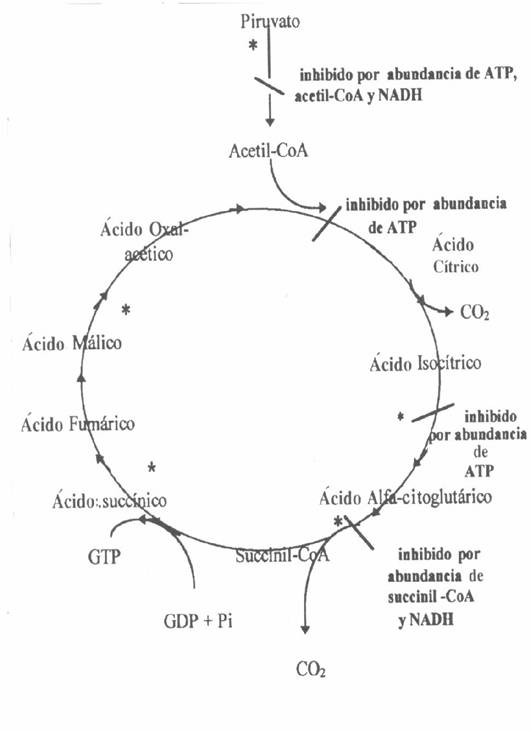
Ciclo de Krebs (fig.1):
§
Se produce en
la matriz mitocondrial.
|
|
Primer etapa:
§
Se produce una
condensación y una hidrólisis, catalizada por una sintasa.
§
La reacción
es unidireccional.
Segunda etapa:
§
La reacción
que se produce es una deshidratación y una hidratación, que se cataliza por una
isomerasa
(aconitasa), y prepara ala molécula para la siguiente etapa.
Tercera etapa:
§
La reacción
es de oxido-reducción, siendo catalizada por una deshidrogenasa, en
presencia de una coenzima NAD.
§
Se produce
liberación de CO2.
Cuarta etapa:
§
La reacción
es de oxido-reducción, siendo catalizada por un complejo enzimático alfa
cetoglutárico deshidrogenasa. Su funcionamiento es idéntico al CE.
Piruvato deshidrogenasa. En presencia de NAD
y CoA. Con la liberación de CO2.
|
|
|
(*) Etapas que requieren un aceptor de
electrones (NAD y FAD). Fig. 1 |
Quinta etapa:
§
En esta etapa
se genera un enlace fosfato de alta energía.
§
Esta reacción
está catalizada por una sintetasa.
§
El GTP cede su ion fosfato de alta energía
a un ADP a través de una quinasa.
Sexta etapa:
§
Se regenera
el Oxalacetato por oxidación del succinico. Los catalizadores son deshidrogenasa
y las coenzimas que intervienen son el FAD
y el NAD.
Reguladores de la velocidad en el Ciclo de Krebs (Fig.1):
§
Uno de los
reguladores es la disponibilidad o no de
NAD o FAD.
§
En la primer etapa,
el ATP es inhibidor alostérico de la
citrato sintasa.
§
En la cuarta
etapa, es un inhibidor alostérico por
[ATP] y por [NADH] . También por falta del ion Mg.
§
En la quinta
etapa, es inhibidor el exceso de succinil-Coa y alta [ATP].
|
Sabía que.... El ciclo de Krebs es una fuente de precursores biosinteticos, pero no se la debe vaciar. Muchos de los componentes intermedio son intermediarios de otros procesos metabólicos, por ejemplo: Del alfa -cetoglutarico se obtiene aminoácidos, lo mismo del oxalacetato. El ciclo debe mantener un mínimo indispensable de este componente para dar entrada al Acetil-CoA. Dado que los mamíferos no presentan una maquinaria para obtener Oxalacetato a partir de Acetil-CoA. El mecanismo de reposición o relleno se logra desde el Piruvato:
|
Transferencia de
los electrones del NADH formado en la glucólisis a la matriz mitocondrial.
§
Lazadera
Aspartato-Malato:


CITOPLASMA
Matriz Mitocondrial
![]()
![]()
![]() NAD Malato Malato NAD
NAD Malato Malato NAD


Oxalacetaso
Oxalacetato NADH
![]()
![]()
![]() NADH
NADH
![]()
Aspartato Aspartato Cadena de
transporte
En el hígado, el riñón y músculos cardíacos.
1-Reduce al mononucleótido de flavina (FMN).
2- Produce 3 ATP.
§
Lazadera
Glierol -3- fosfato:
1-
es un sistema
que requiere más energía que el anterior.
2-
el FADH
reduce directamenta a la coenzima Q
3-
Produce 2
ATP.


CITOPLASMA
Matriz Mitocondrial
![]()
![]()
![]() NAD glicero
3 fosfato glicero 3
fosfato FAD
NAD glicero
3 fosfato glicero 3
fosfato FAD


![]() dihidroxi dihidroxi FADH
dihidroxi dihidroxi FADH
![]() NADH acetona acetona
NADH acetona acetona
fosfato fosfato
Cadena de
transporte
En el cerebro y músculos esqueléticos.
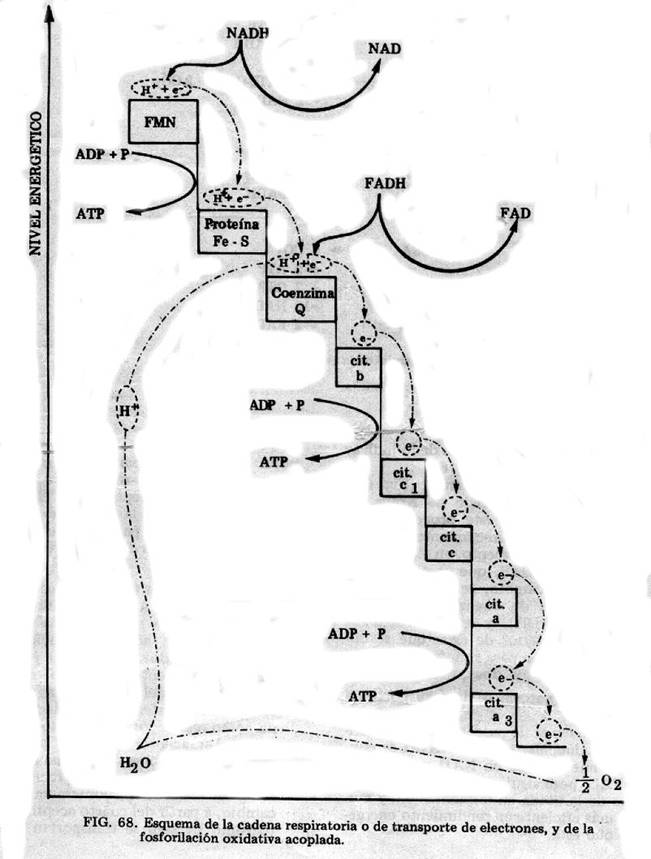
Cadena Respiratoria y fosforilación oxidativa (fig. 2):
§
Estos
procesos se produce en la membrana interna (crestas mitocondriales).
§
Los complejos
proteicos están insertados en la membrana (NADH-Q reductasa, citocromo
reductasa, citocromo oxidasa).
§
El flujo de
electrones, permite el bombeo de protones a través de la membrana.
§
Los grupos portadores
de electrones de estas enzimas son flavinas, complejos de hierro-azufre, grupos
hemo e iones cobre.
|
Fig. 2
|
¿Qué factores pueden
inferir en el sistema de transporte de electrones?
1-
el bajo
suministro o falta de O2
2-
sustancias
que actúan en puntos precisos de la cadena, bloqueando el transporte de
electrones.
Ej.: - El cianuro o el oxido de carbono bloque los citocromos a, a3
y el oxígeno.
·
El amital
(barbitúrico), bloquea ala coenzima Q
El acoplamiento:
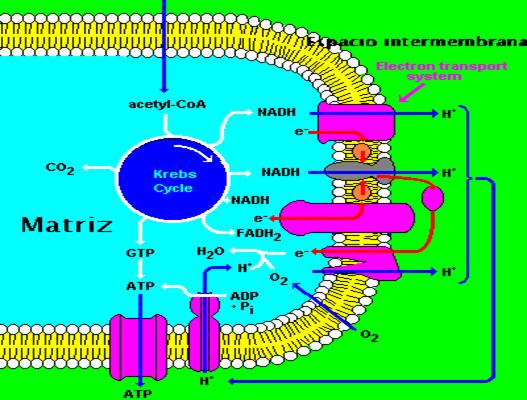
El modelo quimiosmótico (Fig.3):
§
Formación de
ATP a partir de ADP por medio de una ATP-sintetasa
§
Oxidación de
transportadores de H
§
Transferencia
de protones, al espacio intermembranal
§
Sitios de la
cadena donde se transportan los protones:
-
Entre el
NADH-deshidrogenasa y la coenzima Q.
-
Entre el
citocromo b y el citocromo c1
-
Entre el
citocromo a y el citocromo a3
§
PH en el
espacio intermembranal 4, en la matriz mitocondrial 8 y en el citoplasma
celular de 7.
§
Esto genera
dos factores importantes:
a)
Un gradiente
de Ph entre le matriz de la mitocondria y el citoplasma celular (gradiente
electroquímico de protones).
b)
Un potencial
de membrana, negativo hacia el interior de la membrana interna (cresta
mitocondrial) y positivo en el exterior de ella (fuerza protón-motríz).
|
Fig. 3 |
Salida del ATP
desde la mitocondria:
§
Tanto el ADP como
el ATP no se difunden libremente a través de la membrana interna de la
mitocondria. Lo logra por el gradiente de voltaje.
§
Existe un
transportador específico llamado: ATP-ADP translocasa.
§
Este
transportador trabaja en forma acoplada (antiporte), en base de las [ATP y
ADP].
§
Los ATP por
tener una mayor carga negativa, presentan un flujo de movimiento a través de la
membrana de mayor velocidad que el ADP (el ATP es 10 veces mayor en la célula que el ADP).
§
Otros:
El ión fosfato el Ca y el piruvato son introducidos por un sistema de cotransporte acoplado con el flujo de protones hacia fuera, gracias a gradiente de Ph.
EN GENERAL
Regulación de la
velocidad de la fosforilación oxidativa
Es exclusiva de la concentración de ADP.
|
Sabía que ...
El gradiente de protones puede ser
desacoplado para producir calor. Este desacoplamiento entre la fosforilación oxidativa
y el transporte de electrones en la cadena respiratoria puede ser
biológicamente útil. Es un medio de generar calor que mantiene la temperatura
corporal en los animales durante la hibernación, en algunos animales recién
nacidos (incluso en los seres humanos) y a los mamíferos adaptados al frío. El
desacoplamiento del transporte de electrones y la fosforilación pueden ser
causados por la presencia de DNP (2-4dinitrofenol) y algunos otros compuestos
aromáticos de carácter ácido. Estas sustancias transportan protones a través
de la membrana interna de la mitocondria. En presencia de estos
desacoplantes, la cadena de transporte se produce con normalidad, pero deja
de funcionar Las
células del tejido adiposo oscuro, ricas en mitocondrias, están
especializadas en el proceso de termogénesis.
En estas células existe una proteína desacoplante que abre una vía de flujo
de protones desde el citoplasma hacia la matriz. Este sistema genera calor
desacoplando la producción de energía Esta vía de disipación del gradiente de
protones se activa con los ácidos grasos liberados de los triglicérido en
respuesta a determinadas señales hormonales. La col olorosa tiene un
mecanismo similar que calienta su inflorescencia, lo cual incrementa la
evaporación de moléculas odoríferas que atraen insectos que fecundan las
flores. |
Destino de la
glucosa dentro del cuerpo Humano:
Glucosa absorbida
![]() Del intestino
Del intestino
![]()
 Hígado Glucosa en
Hígado Glucosa en

![]() Células Gluconeogénesis
Células Gluconeogénesis
![]()
![]() Glucogénesis Glucogenólisis respiración
Glucogénesis Glucogenólisis respiración
celular glicerol

![]() Glucosa glucosa aminoácido
Glucosa glucosa aminoácido
CO2 + H2O + Energía
![]() Exeso Necesidades
Exeso Necesidades
![]()
![]() Glucógeno
Glucógeno
![]()
Cuando se llenan los
depósitos
Glicerol + ácidos grasos
Aminoácidos
![]()
 De
glucógeno la glucosa se
De
glucógeno la glucosa se
convierte en
![]()
transportados
Almacenados
![]() hacia
como
hacia
como
![]()
![]() Glicerol + ácidos grasos Adipositos grasa Proteínas
Glicerol + ácidos grasos Adipositos grasa Proteínas
![]()
![]()
Cuando no hay glucosa
ni glucógeno disponible
Metabolismo de
los Ácidos Grasos:
Principales funciones fisiológicas de los ácidos grasos:
1-
Forman parte
de los fosfolípido y glicolípidos.
2-
Muchas de
estas moléculas actúan como hormonas o mensajeros intracelulares.
3-
Son moléculas combustibles.
|
Escala
de Energía de los distintos compuestos orgánicos:
|
Catabolismo de los
ácidos grasos:
Primera etapa (lipólisis): Esta etapa se produce en el citoplasma celular. Las lipasas realizan la hidrólisis de los triglicérido.
a)
La hormonas
(adrenalina, noroadrenalina, glucagón y la adrenocorticotropa), estimula
b)
AMPciclico se
incrementa y estimula a la proteína quinasa, y se activa la lipasa por
fosforilación.
c) Una actividad inhibitoria de la lipolisis, la tiene la insulina que
inactiva a la adenilato ciclasa
|
Resumen ... El glicerol
formado se fosforila y se convierte en PGAL, en el citoplasma de las células. Los ácidos
grasos se oxidan y dividen enzimáticamente en compuestos de dos carbonos
unidos a la coenzima A (acetil-CoA) en la matríz mitocondrial. Luego las
moléculas de Acetil CoA entran el el ciclo de Krebs y se convierten en CO2
liberando hidrógeno. |
¿Como logra la b-oxidación?
Segunda etapa:
a)
Los ácidos
grasos se activan en
la membrana externa de la mitocondria, reaccionando con una
molécula de ATP y un conjunto de enzimas y CoA.
b)
Los ácidos
grasos activados pasan la membrana interna a través de un transportador
llamado carnitina
(derivado de la lisina) y una
translocasa (fig.4)
|
Citoplasma
Acetil CoA CoA
Carnitina Acilcarnitina Membrana Interna Translocasa Membrana interna
Carnitina
Acilcarnitina
Acetil
CoA CoA
Matriz de la mitocondria Fig.4 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
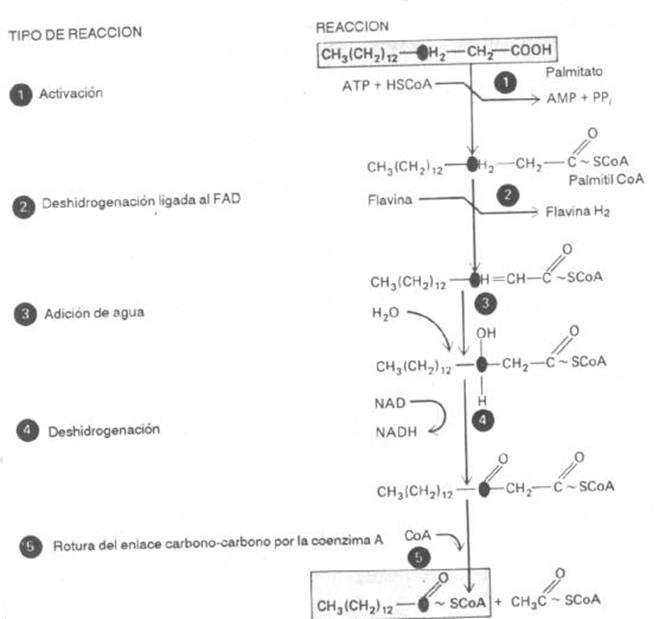
Tercera etapa (oxidación): (fig.5)
a)
Deshidrogenación
ligada al FAD, entre el 2 y 3
carbono del ácido graso, produciendo una doble ligadura ( C = C ).
b)
Hidratasa
(crotonasa) adiciona una molécula de H2O
en la doble ligadura.
c)
Deshidrogenación
ligada a un NAD, quedando un ácido
graso de cadena larga con un grupo C = O en el carbono b, y una CoA unida al grupo carboxilo.
d)
Una b-cetotiolasa y una CoA,
realizan la escisión de una molécula de Acetil-CoA y el resto del ácido
graso.
|
Sabia que ... Para la oxidación de
los ácidos grasos insaturados se requiere de una isomeras y una epimerasa
para lograrlo. La
isomerasa convierte un enlace cis en uno trans. Y la epimerasa invierte la
configuración del grupo hidroxilo del C3 para que luego de la
hidratación se produzca la
deshidrogenación en presencia de NAD. En el caso de los
ácidos grasos de carbonos impares, la degradación es idéntica. Pero al final
deja un compuesto de 3 carbonos llamado Propionil-CoA
el cual se convierte en Succinil- CoA
el cual se incorpora al ciclo de Krebs. |
|
Fig 5 |
Los lípidos dentro del cuerpo Humano

GRASA
![]() Transportado
como
Transportado
como
Albúmina, ácidos grasos
![]() Glicerol + ácidos
grasos
Glicerol + ácidos
grasos
Adiposito

![]()
![]() Glicerol + ácidos grasos
Glicerol + ácidos grasos
b-Oxidación Hígado
PGAL Usado para fabricar
![]()
![]() triglicéridos
triglicéridos
Glucosa Acetil CoA

![]()
Ingresa a la
respiración celular
formación de otros cuerpos cetónicos
![]() lípidos
lípidos
Ingresa a la respiración celular

Cuerpos cetónicos
![]()
![]() Convertidos
en Transformados en
otros lípidos
Convertidos
en Transformados en
otros lípidos
Piruvato o acetil CoA
![]()
Entran en la respiración celular
Célula
Oxidación de
Proteínas:
En general todos aquellos aminoácidos que se presentan en exceso y no forman estructuras proteicas, no pueden ser almacenadas y serán utilizados como combustible metabólico.
Para lograrlo se deberá realizar una sucesiva metabolización de estas moléculas.
Primera etapa:
Retirar los grupos amino, a través de una desaminación por medio de una transaminasa y una deshidrogenasa. Esta última enzima es alostérica y se regula a través de la presencia de ATP y GTP. Cuando hay en el medio alta cantidad de ADP o GDP se activa el proceso de degradación de aminoácidos.
Segunda etapa:
a)
El producto
de la desaminación se convierte en NH4
luego se transforma en Urea y luego
se excreta vía urinaria.
b)
Los carbones
de los aminoácidos degradados aparecen en los principales intermediarios
metabólicos.
Ej.:
-
La familia C3:
la alanina, serina y cisteína se convierte en piruvato.
-
La familia C4:
el aspartato y la asparagina se convierten en Oxalacetato.
-
La familia
C5: la glutamina, prolina, arginina y la histidina se convierte previamente en
glutamato y por último en a-Cetoglutárico.
Las Proteínas
dentro del cuerpo Humano
![]()
![]()
![]() ANABOLISMO
ANABOLISMO
![]()
![]()
![]()
![]()

![]()
![]()
![]() Aminoácidos
Aminoácidos
Proteína hemoglobina Miosina
enzima
Estructural actina
Catabolismo
Exceso de aminoácidos

![]()
Desaminación
Proteínas plasmáticas
![]() a-cetoácidos + NH3 (amoniaco)
a-cetoácidos + NH3 (amoniaco)
![]()
![]()
![]() Urea
Urea
![]()
Grasa Piruvato
riñones
![]() Acetil CoA Ingresa a
Acetil CoA Ingresa a
a-Cetaglutarico la respiración
celular
Cuerpos cetónicos
![]() Hígado
Hígado

![]() Acetil CoA
Acetil CoA
Acidos grasos
![]() Almacenamiento de
Almacenamiento de
Glicerol
![]() adipositos
adipositos
Triglicéridos